Опыт по химии вулкан на столе
Обновлено: 26.04.2024
3909 дн. с момента
Новый 2012 год
Химический вулкан
Химия – наука экспериментальная, эксперимент учит на практике проверять свои выводы. Ломоносов говорил: «Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции»
Мы выбрали следующий опыт
(Возможности ресурса смотри приложение: презентация с фотографиями рабочего окна ресурса)
(Химический вулкан)
1.Познакомить с признаками и условиями течения химических реакций(экзотермическое разложение, окислительно-восстановительная реакция).
2.Пробудить у учащихся интерес к химии и показать, что эта наука является не только теоретической.
3.Создать условия для развития у учащихся умения анализировать результаты лабораторных исследований.
(Также целью этого опыта может быть получение оксида хрома (III) Cr2O3)
Техника безопасности . В отличие от физических явлений при химических явлениях, или химических реакциях, происходит превращение одних веществ в другие, образуются новые вещества, обладающие другими свойствами. Об этом можно судить по внешним признакам. Эти признаки называются признаками химических реакций. Помните, что любые химические опыты требуют при выполнении осторожности, внимания, аккуратности. Избежать неприятностей поможет соблюдение простых правил:
Опыт следует выполнять в вытяжном шкафу при включенной вентиляции (или на открытом воздухе). Внимание! На время опыта следует надеть защитные очки! Происходит бурное выбрасывание продуктов разложения! Не наклоняться над "вулканом", не вдыхать аэрозоль оксида хрома. Исходное вещество и продукт реакции ядовиты при попадании внутрь. Не брать вещества руками, после опыта вымыть руки!
Приборы и реактивы : фарфоровая ступка, асбестовая бумага или металлическая пластинка , стеклянная палочка ; спички; дихромат аммония (NH4)2Cr2O7 (измельченный), этиловый спирт.
Для проведения опыта химический "вулкан" растираем тщательно в фарфоровой ступке 50 г кристаллов дихромат аммония (NH4)2Cr2O7. Чтобы было легче собрать продукт реакции, следует застелить прилегающую к месту опыта поверхность листом фильтровальной бумаги.
Далее на лист асбестовой бумаги или металлическую пластинку насыпают (NH4)2Cr2O7 таким образом, чтобы образовалась форма горки. Палочкой на вершине горки делаем отверстие и вливаем в него несколько миллилитров этилового спирта (С2Н5ОН). Поджигаем спирт спичкой, спирт загорается и начинается процесс бурного разложения аммония дихромата.
При этом из «кратера» выбрасываются яркие искры и «вулканический пепел» - грязно-зеленый Cr2O3, при этом объем его во много раз превышает объем взятого аммоний дихромата:
Экзотермическое разложение (NH4)2Cr2O7 очень напоминает извержение настоящего вулкана, особенно на заключительной стадии, когда снопы красных искр прорываются из глубины пушистого Cr2O3.
Реакция разложения дихромата аммония протекает с выделением большого количества тепла, поэтому после поджигания соли она протекает самопроизвольно - до тех пор, пока весь дихромат не разложится.
Вывод : оксид хрома (III) Cr2O3 получается путем нагревания дихромата аммония. Реакция разложения дихромата аммония относится к окислительно-восстановительным реакциям. Она начинается после предварительного нагревания, протекает бурно, с выделением большого количества теплоты. Наблюдается выделение газа, образование раскаленных частиц оксида хрома (III). Потоком газа раскаленные частицы оксида хрома (III) увлекаются вверх. Разрушение кристаллов дихромата аммония сопровождается характерным потрескиванием. t (NH4)2Cr2O7 = Cr2O3 + 4H2O↑ + N2↑ Эта реакция относится к группе реакций внутримолекулярного окисления и восстановления. Окислителем является элемент хром, степень окисления которого изменяется от +6 до +3, а восстановителем азот, степень окисления которого изменяется от -3 до +0.
Утилизация отходов: оксид хрома ( III ) собрать в емкость для проведения дальнейших экспериментов.
Опыт по химии вулкан на столе
Химический вечер "Занимательные опыты"
занимательные факты по химии (8 класс) по теме
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Выполнила учитель химии Панченко П.С.
Внеклассное мероприятие по химии
- Подчеркнуть значение химии в жизни человека,
- Продолжение знакомства учащихся с химией,
- Повышение познавательной активности учащихся к химии, продемонстрировав ее занимательную сторону,
- Воспитание соблюдения правил техники безопасности, на примере выполнения демонстрационных опытов
Место проведения мероприятия : кабинет химии.
Оборудование: штатив с пробирками, коническая колба, химические стаканы, спички, стеклянные палочки, лабораторный штатив, скальпель, вата, фарфоровая чашка, лучина.
Карбонат натрия, раствор NH 3 10%-ный, соляная кислота (конц.), серная кислота (конц.), сахарная пудра, порошок магния, хлорид кальция 10%-ный раствор, хлорид бария 10%-ный раствор, сульфат магния 10%-ный раствор, гексацианоферрат калия 5%-ный раствор, хлорид железа 10%-ный раствор, нитрат калия (насыщ. р-р.), дихромат калия, гидроксид натрия 20%-ный раствор, серная кислота 10%-ный раствор, тиоцианат калия, фторид лития.
Подготовка к мероприятию: до начала мероприятия были распределены роли между студентами-проктикантами, все опыты были заранее проделаны .
- Г. П. Хомченко, Ф.П. Платонов, И.Н. Чертков Демонстрационный эксперимент по химии. Пособие для учителей. М.: Просвещение, 1978.
- Занимательные задания и эффектные опыты по химии/ Б.Д. Степин, Л.Ю. Аликберова. – М.: Дрофа, 2006.
- М. Ю Горковенко. Поурочные разработки по химии: 8класс.- М.: ВАКО, 2007.
Химия – удивительная наука. С одной стороны, она очень конкретна и имеет дело с бесчисленными полезными и вредными веществами вокруг нас. Она нужна всем: повару, шоферу, садоводу, строителю и многим другим. С другой стороны это наука абстрактна: она изучает мельчайшие частицы, которые не увидишь в самый сильный микроскоп, рассматривает грозные формулы и сложные законы.
Если считать первыми химиками древнеегипетских жрецов, то химия – наука- старушка, ей несколько тысяч лет. Вместе с тем постоянно открываются новые области этой старой науки, синтезируются новые вещества, появляются новые методы их получения и исследования… И старая наука молодеет…
И так, объявляю вечер, посвященный химии открытым.
Сейчас мы проведем и покажем ряд демонстрационных опытов, которые откроют для вас красивую и таинственную сторону химии…»
Один из опытов проведем в два этапа, один из которых, подготовительный, будет сейчас и для него нужны помощники, а другая часть будет немного позже… (говорит Н. П.)
Одному добровольцу из 8 «А» дали лист бумаги и стакан с насыщенным раствором KNO 3 , и попросили что-нибудь написать, то же самое сделали с добровольцем из 8 «В» класса, но раствором желтой кровяной соли. После чего листочки повесили сушиться на штативы, так что бы они были на глазах у учеников.
Наверни-ка, в некоторых фильмах вы видели, как из чего-нибудь, например, из вазы или кувшина, выходит облако. Давайте выпустим свое облако. ( говорит и демонстрирует А. А.)
Описание опыта: В колбу емкостью 2 – 3 литра насыпаем порошок карбоната натрия слоем 1 – 2 см и осторожно наливаем 10%-ный раствор аммиака в таком количестве, чтобы его слой, покрывающий кристаллы, был не толще 2мм. Затем очень тонкой струйкой вливаем в колбу немного концентрированной соляной кислоты. Из горла колбы вырывается плотная струя густого белого дыма, который под собственной тяжестью сползает по ее наружным стенкам и стелется по поверхности стола.
Химия, удивительная наука, она может превращать воду в молоко, творог или газировку. Сейчас я это вам продемонстрирую (говорит и демонстрирует А. А.)
Описание опыта: В один стакан насыпают 2 чайные ложки хлорида кальция СаС1 2 , а в другой — столько же карбоната натрия Na 2 C0 3 и наливают в каждый стакан воды примерно на 1/4 их объема. Затем полученные растворы сливают вместе, и жидкость становится белой, как молоко. Этот опыт надо демонстрировать быстро, так как карбонат кальция СаС0 3 выпадает в осадок и зрители могут заметить, что это вовсе не молоко. Но если добавить к смеси избыток соляной кислоты, то «молоко», закипев, мгновенно превращается в «газированную воду».
Если к разбавленному водному раствору хлорида бария ВаС1 2 добавить раствор сульфата калия MgS0 4 , образуется белый осадок сульфата бария BaS0 4 , похожий на творог.
Обладая некоторыми специальными химическими знаниями можно перейти из одного сока в другой (говорит и демонстрирует Н. П.)
Описание опыта: Сначала показываем зрителям стакан с раствором дихромата калия, который оранжевого цвета. Потом, добавив щелочь, превращаем «апельсиновый сок» в «лимонный». Затем делаем, наоборот: из «лимонного сока» — «апельсиновый», для этого добавляем немного серной кислоты, затем добавляем немного раствора пероксида водорода и «сок» стал «яблочным».
Обратного хода от «яблок» к «апельсинам» и «лимонам» нет: окислительно-восстановительную реакцию повернуть вспять не удастся.
Некоторые химики научились творить настоящие чудеса, с помощью изготовленной ими же живой воды заживляют раны. (Говорит и демонстрирует Н. П.).
Описание опыта: Заранее готовили растворы хлорида железа (Ш), тиоцианата калия , фторида лития. Выбрали добровольца, смочите ватку «спиртом» (тиоцианат калия) и протерли ему руку, затем продезинфицировали скальпель, раствором «иода» (хлорид железа (Ш)). Провели «скальпелем» по участку кожи, обработанному «спиртом», и потекла «кровь». После этого «заживляем рану», для этого смачиваем ватку в «живой воде» (раствор фторид лития). «Кровь» исчезнет, а под ней — здоровая кожа.
- «Огненная надпись» (демонстрирует А. А.) и «секретные чернила» (демонстрирует Н. П.)
А теперь подошло время для выполнения опытом, для которых делали заготовки в начале вечера. (горит Н. П.).
- Н. П. снимает листочек со штатива и демонстрирует его, на нем ничего нет, затем протирает его ваткой, смоченной в растворе хлорида железа (Ш), на желтом фоне появляется синяя надпись.
- А. А. демонстрирует второй чистый листок, висящий на штативе, и не снимает его, а подносит к нему тлеющую лучину. Листок не загорается, а лишь обугливается высохшая надпись.
- Костер без спичек
В походе может возникнуть ситуация, при которой спички промокли, зажигалка сломалась или потерялась, но это не помеха для человека знакомого с химией, он может разжечь костер без спичек или зажигалки. Сейчас я покажу способ, как это можно сделать (говорит и демонстрирует А. А.)
Описание опыта: делаем смесь, размером с горошину из кристаллического перманганата калия и концентрированной серной кислоты. Помещаем смесь в фарфоровую чашечку и сверху на нее ложем лучинки (дрова), таким образом, что бы они не касались смеси. Смачиваем ватку обильно спиртом и выдавливаем каплю спирта на смесь. Костер загорается.
Многие дети любят мороженое, химики тоже любят это лакомство, но на этом они не остановились и придумали свой способ приготовления эскимо. (говорит и демонстрирует Н. П.)
Описание опыта: Сахарную пудру помещаем в высокий стеклянный стакан, смачиваем ее водой и перемешиваем стеклянной палочкой, до получения густой кашеобразной смеси, затем приливаем по палочке концентрированную серную кислоту и быстро перемешиваем смесь в стакане. В скором времени содержимое стакана начинает чернеть, вспучиваться и в виде объемистой, рыхлой и ноздреватой массы поднимается, увлекая вверх стеклянную палочку.
По имени Вулкана, бога огня древних римлян, названы огнедышащие горы – вулканы, внезапно просыпающихся и уничтожающие окрест все живое во время страшных извержений. Свои домашние вулканы придумали и химики, самый известный из которых проделал немецкий химик Рудольф Бёттгер. Он получил оранжево-красное вещество и решил испытать его на способность воспламеняться от горячей лучины. Давайте посмотрим, что же произошло (говорит и демонстрирует А. А.)
Описание опыта: Насыпаем немного дихромата калия в фарфоровую чашечку, затем добавляем немного порошка магния, хорошо перемешиваем смесь и формируем в чашечке горкой. Прикасаемся к вершине «вулкана» горящей лучиной. Горящая смесь выбрасывает большое количество искр, это напоминает извержение вулкана. Сам вулкан при этом непрерывно растет и меняет цвет, из оранжевого в зеленый.
Спасибо за внимание. Наш химический вечер подходит к концу. Мы надеемся, что вам все понравилось и вы по другому взглянули на эту сложную и иногда скучную науку. (говорит Н. П.)
Внеклассное мероприятие по химии. Занимательный час "Чудеса своими руками"
Дорог в химии, как и в любой науке, кроме занимательного много трудного, но трудно да интересно! Это то, что мыслящему человеку как раз и нужно, чтобы ум наш не находился в праздности и лености, а постоянно трудился и трудился. В конце нашей встречи я задам вам только один вопрос. А теперь приступаем к чудесам!
- Жарко здесь. Хочу я пить. У кого воды спросить?
- Ой, а я люблю с сиропом, только чтоб чуть- чуть, немного,
- Братцы мне нужна корова, молочка хочу парного.
Выходит пятый ученик.
Вы, ребята, пить хотите? В колбе сказочная жидкость, чудеса мне по плечу, я ведь химию учу. Подставляйте все стаканы, опыт вместе проведём.
Ребята берут со стола и подставляют стаканы, в которых на донышке налиты растворы необходимых веществ.
вот вода, вот газировка, вот парное молоко, получилось очень ловко, а секрет узнать легко.
Ребята делают вид, что хотят выпить содержимое стаканов.
стоп, ребята, погодите, чтобы не было беды, вы пожалуйста, не пейте ни сиропа, ни воды. В этом строгом кабинете есть серьёзные запреты. Все запомните , друзья, здесь ни пить, ни есть нельзя!
Мы знакомы с чудесами, их умеем делать сами.
5 ученик Чудо первое свершилось, что в стаканах находилось?
1 ученик А ответ совсем простой: был у меня стакан пустой.
2 ученик У меня в стакане сода.
3 ученик У меня -- метилоранж.
4 ученик В моём был бария хлорид.
5 ученик О чём всё это говори? Угадайте, восьмой класс. Мы надеемся на вас! Не составит вам труда понять, что в колбе . ( кислота ).
6 ученик У меня спокойный опыт без огня и пламени, Буду задавать вопросы. Восьмой класс, внимание!
Делает опыт с фенолфталеином.
Не страшны кислоты мне, даже очень сильные, но в растворах щелочей становлюсь малиновым. Ярче сока всех малин. Кто я? ( Фенолфталеин ) ребята! Сегодня здесь собрались ученики 7, 8 классов. У каждого из вас своя задача. Восьмиклассники приготовили интересные опыты и покажут вам различные «чудеса», раскроют секрет каждого «чуда».
Семиклассники, вам предстоит ответить на главный вопрос: интересная ли наука химия, хочется ли вам ее изучать?
Делает опыт с метилоранжем.
В щелочах я очень жёлтый, а в кислотах очень красный. В среде нейтральной - цвет оранжевый, прекрасный. Индикатор очень важный. Как зовусь я? (Метилоранжевый)
Делает опыт с бумажкой универсального индикатора. Эта жёлтая бумажка всё укажет без труда, посинеет в колбе щёлочь, покраснеет кислота. Коль нейтральная среда, не изменит цвет она. Мы за эти указания как зовём её?( Лакмусовой )
Девятый класс, внимание будет вам задание. На обычную дощечку наливается вода и стаканчик с талым снегом тоже ставиться туда. Насыпаю в стакан соль, А ты дружок( помощнику ) , мешать изволь. Я считаю до пяти, а ты всё палочкой крути. ( Медленно считает) Примёрз стакан химический. Как называется процесс? Процесс эндотермический.
В сё вода, снег да раствор, надоевший разговор. У меня другие планы: разожгу на сетке пламя. Поджигает горку белой смеси пропитанной спиртом. Я ещё не то умею, из песка полезут змеи. Страшные, кусачие, от страха не заплачете? Не боитесь? Ну, смотрите! Чтобы змеек посмотреть, надо хорошо прогреть, а пока я
их бужу, про другое расскажу.
( рассказывает рассказ, т.к. нагревать надо долго )
Как - то летом очень долго у меня болело горло. Прописали от ангины полоскать фурацилином. Всё- таки прошла ангина, а того фурацилина два флакончика осталось. Нынче мы белили стены, от извёстки руки мыли. Я решила в эту воду старое лекарство вылить. Удивилась я ужасно, даже вздрогнула, когда стала рыжевато-красной
известковая вода. Принесла остаток в школу, и теперь фурацилин щёлочь нам определяет, как фенолфталеин. Не меняет цвет в воде, не меняет в кислоте, в щелочах фурацилин яркий будто апельсин. ( Опыт «Чёрные змеи « идёт, объясняем его ) Спирт горит и выделяет очень много теплоты. Соду жаром разлагает он до углекислоты. Он обугливает сахар, вот откуда чернота. Пузырьками вспенит сахар эта углекислота. Всё понятно? Ясно тут, «змеи» отчего ползут.
Вот ещё одно развлечение. Кто даст руку на отсечении? Жалко руку на отсечение, тогда нужен больной для лечения (Приглашают семиклассника) Оперируем без боли, правда, будет много крови. При каждой операции нужна стерилизация. Помогите ассистент,
Дайте йод! «Йодом» смочим всё обильно, чтобы было всё
стерильно. Не вертитесь пациент. Нож подайте, ассистент.
Делаем ножом «разрез, течёт «кровь». Посмотрите, прямо струйкой «кровь» течёт, а не вода, но сейчас я вытру руку, от разреза нет следа. Этот опыт мы пока объяснить не можем. В класс девятый перейдём, объяснения найдём.
Устанавливает на столе готовую модель вулкана, зажигает спиртовку, нагревает стеклянную палочку. А сейчас друзья, для вас по истории рассказ. Ночью или утром рано спали горожане. Вдруг из кратера вулкана показалось пламя. Гул и грохот,через жерло льют потоки лавы. Так под лавой и под пеплом погиб город славный. Покажу вам, как сумею, гибель города Помпеи. (Прикасается нагретой палочкой к вулкану. Начинается «извержение вулкана») Вам запомнится надолго это извержение. Тип реакции, какой? Реакция разложения.
Наше время истекло, но мы вам показали не всё, что умеем делать. Мы умеем говорить на химическом языке. Медные монеты превращать в «серебряные» Устраивать «грозу» в пробирке и ещё многое другое. Этому и вы научитесь в будущем году, если будите изучать самую интересную науку—химию.
Вот и закончился наш занимательный час. Интересные секреты скрыты в этом кабинете. Жду вас в будущем году. Что мне каждый скажет? Я. Приду! Так приходите! Я вас жду!
Методика выполнения опытов.
Кровавый опыт
Для получения «крови» будем использовать реакцию между роданидом и солью железа( III ), например:
Можно записать упрощенный вариант уравнения с образованием малодиссоциирующего продукта:
FeCl 3 + 3 KSCN ® Fe ( SCN )3 + 3 KCl
Fe 3+ + 3 SCN – ® Fe ( SCN )3.
Обычно для реакции используют роданид калия или аммония и хлорид железа( III ). В ходе ее протекания образуется кроваво-красный автокомплексный роданид.
Для опыта необходимо взять стаканы с растворами роданида калия (аммония) и хлорида железа( III ), а также две стеклянные палочки с намотанной на них ватой. Подготовьте пластмассовый или стальной нож. Он должен быть затупленным, иначе опыт может стать действительно кровавым.
Ладонь протрите раствором соли железа (зрителям можно сообщить, что это дезинфекция раствором йода. Нож смочите раствором роданида (зрителей можно снова «обмануть» – сказать, что это спирт). Далее начинайте себя «резать» ножом. Появляется «кровь».
Для удаления «крови» также используем реакцию комплексообразования:
Упрощенно : Fe(SCN)3 + 3NaF ® FeF3 + 3NaSCN.
Фторидный комплекс железа( III ) бесцветный. Поэтому, если протереть «рану» ватой, смоченной в растворе фторида натрия, роданидный комплекс разрушается, и образуется более устойчивый комплекс [ FeF 6 ] 3– . «Кровь» исчезает. Зрителям показывают, что на ладони раны нет.
"Вулкан на столе"
Очень часто это опыт называют "Вулкан на столе". Для его проведения возьмите дихромат аммония и насыпьте его горкой на термостойкую поверхность (например, кафельную плитку). Сверху сделайте «кратер», в который поместите небольшой кусочек ваты, смоченный спиртом. Спирт подожгите. Соблюдайте осторожность! Дихромат аммония начинает разлагаться с выделением азота и паров воды, вспучивающих смесь, а также серо-зеленого оксида хрома( III ):
Реакция напоминает действующий вулкан. После ее завершения оксид хрома( III ) занимает объем примерно в 2–3 раза больший, чем исходное вещество. Следует учесть, что частицы образующегося оксида хрома( III ) – «вулканическая пыль», будут оседать вокруг «вулкана», поэтому опыт необходимо проводить на большом подносе.
К дихромату аммония можно добавить немного порошка магния, тогда «вулкан» будет «извергаться» еще ярче.
Оборудование и реактивы:
1. пустой стакан
2. стакан гидрокарбонат натрия
3. стакан метилоранж
4. раствор бария хлорида
Стакан, фенолфталеин, щелочь.
1 пробирка метилоранж, кислота.
2 пробирка метилоранж, щелочь.
3 пробирка вода, метилоранж.
1 колба лакмус, кислота.
2 колба лакмус, щелочь.
3 колба лакмус, вода.
Дощечка, стакан с водой, хлорид аммония.
Сухое горючее, таблетки глюконата кальция. ( Опыт « фараоновы змеи»)
Раствор фурацилина, щелочь, кислота, вода.
Раствор хлорида железа(│││), роданид аммония или роданид калия, фторид натрия, вата, нож.
Керамический диск, дихромат аммония, сухое горючее, спирт этиловый, спички, треножник.
Вулкан Бёттгера. Эксперимент. (запись №6)

Дихромат аммония - это соль, в состав которой входят окислитель и восстановитель. Поэтому "внутри" соли может пройти экзотермическая окислительно-восстановительная реакция.
Окислителем является хром ( VI ), который в результате реакции превращается в хром ( III ). В результате этого образуется зеленый оксид хрома.
Восстановитель - это азот, который входит в состав иона аммония. В результате реакции он превращается в газообразный азот.
(NH4)2Cr2O7 = N2 + 4H2O + Cr2 O 3

Немецким химиком Рудольфом Бёттером в 1843г. было получено оранжево-красное кристаллическое вещество - дихромат аммония (NH4)2Cr2O7.
Ученый решил провести опыты по способности вещества взрываться от удара и загораться от лучины. При ударе кристаллы дихромата аммония превратились в порошок.
После чего ученый поднес к горке порошка горящую лучину. Возгорания не произошло, но вокруг лучинки начали подпрыгивать раскаленные частицы вещества, а горка начала увеличиваться.
Также изменился ее цвет, он стал зеленым.

Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) и при взаимодействии с водой.
Металлы, стоящие в ряду правее водорода, с водными растворами кислот - неокислителей при обычных условиях не взаимодействуют.

Дихромат аммония до термической реакции (фото из интернета, не мое)


6.7K пост 72.8K подписчиков
Правила сообщества
ВНИМАНИЕ! В связи с новой волной пандемии и шумом вокруг вакцинации агрессивные антивакцинаторы банятся без предупреждения, а их особенно мракобесные комментарии — скрываются.
Основные условия публикации
- Посты должны иметь отношение к науке, актуальным открытиям или жизни научного сообщества и содержать ссылки на авторитетный источник.
- Посты должны по возможности избегать кликбейта и броских фраз, вводящих в заблуждение.
- Научные статьи должны сопровождаться описанием исследования, доступным на популярном уровне. Слишком профессиональный материал может быть отклонён.
- Видеоматериалы должны иметь описание.
- Названия должны отражать суть исследования.
- Если пост содержит материал, оригинал которого написан или снят на иностранном языке, русская версия должна содержать все основные положения.
Не принимаются к публикации
- Точные или урезанные копии журнальных и газетных статей. Посты о последних достижениях науки должны содержать ваш разъясняющий комментарий или представлять обзоры нескольких статей.
- Юмористические посты, представляющие также точные и урезанные копии из популярных источников, цитаты сборников. Научный юмор приветствуется, но должен публиковаться большими порциями, а не набивать рейтинг единичными цитатами огромного сборника.
- Посты с вопросами околонаучного, но базового уровня, просьбы о помощи в решении задач и проведении исследований отправляются в общую ленту. По возможности модерация сообщества даст свой ответ.
Наказывается баном
- Оскорбления, выраженные лично пользователю или категории пользователей.
- Попытки использовать сообщество для рекламы.
- Многократные попытки публикации материалов, не удовлетворяющих правилам.
- Нарушение правил сайта в целом.
Окончательное решение по соответствию поста или комментария правилам принимается модерацией сообщества. Просьбы о разбане и жалобы на модерацию принимает администратор сообщества. Жалобы на администратора принимает @SupportComunity и общество пикабу.
стесняюсь спросить про аммония перманганат
Химики для меня как шаманы
Металлы, стоящие в ряду левее водорода
я химию не знаю, но какие металлы стоят левее водорода и в какой геометрии?

К последним новостям мира науки
Один из крупнейших научных издательских домов Elsevier начал отправлять рецензентам анкеты с вопросами о. гендерной и расовой принадлежности.
Делается это, по словам редакции «для поддержки инклюзивности науки». В частности, инклюзивность решили внезапно поддержать в таких журналах, как Chemical engineering journal и Journal of Alloys and Compounds (само собой, никоим образом не связанных с исследованиями гендерных и расовых вопросов)


Кроме того, забавно видеть от научного издательства постановку вопроса «Каким бы расовым термином вы бы себя определили?»
И далее идёт перечисление «рас»:
Азиаты или жители Океании
Черные
Испанцы или латиноамериканцы
Коренные народы (североамериканские индейцы, южноамериканские индейцы и т.п.)
Ближневосточные или североафриканские жители
Белые
Собственное описание
Толерантность, инклюзивность и всё такое — это, конечно, хорошо, однако расоведение (раздел антропологии, изучающий человеческие расы) выделяет всего четыре расы человека (европеоидная, монголоидная, негроидная, австралоидная) и десятки малых антропологических типов. В списке же намешаны расы, народы, языковые группы и даже возможность самоопределить себя в отдельную расу.
Извините, другой науки у нас для вас нет 🌚
Правда ли, что употребление соли вредно?

Один из самых популярных мифов о питании гласит, что соль — это белая смерть, она вредна для здоровья. Мы решили проверить, правда ли это.
(Специально для любителей расширения сознания — речь идет про поваренную соль, которая хлорид натрия)
(Самое важное для ЛЛ: утверждение, что соль вредна, абсолютно некорректно. При этом к проблемам со здоровьем может привести как ее дефицит, так и избыток в суточном рационе)
Информацию о том, насколько соль опасна для нашего организма, можно найти на сайтах медицинских учреждений, например больниц. Об этом пишут СМИ, даже специалисты ООН бьют тревогу. Рассуждения о том, стоит ли полностью отказываться от соли, можно найти на порталах о диетологии и здоровом образе жизни. Стереотип о том, что соль — это яд, настолько распространён, что его можно встретить даже в кино.
1. Дефицит соли
Соль на 97% состоит из хлорида натрия и служит одним из основных источников этих элементов для нашего организма. Натрий — электролит, который играет важную роль в поддержании водно-солевого баланса (логично), а также обеспечивает передачу нервных импульсов.
Сама по себе нехватка натрия в крови — уже достаточно серьёзное заболевание, гипонатриемия. Оно может привести к тяжёлым неврологическим и психическим нарушениям, судорогам, коме и даже смерти. Ещё одна опасность низкого содержания натрия в организме — обезвоживание, которое тоже может привести к тяжёлым последствиям для здоровья. И обезвоживание, и гипонатриемия особенно опасны для людей старшего возраста. Натрий выводится из нашего организма естественным образом с мочой и потом. Именно поэтому спортсмены после тяжёлых тренировок могут ощутить нехватку натрия, один из её симптомов — мышечные спазмы.
В 2016 году специалисты Кокрановской библиотеки изучили результаты различных исследований о взаимосвязи потребления соли, давления и холестерина и выяснили, что диета с пониженным содержанием соли способствует некоторому повышению холестерина и триглицеридов в крови. А это, в свою очередь, может привести к заболеваниям сердца. Кроме того, пищевую соль часто обогащают железом, йодом и фолиевой кислотой, поэтому её употребление может восполнить и нехватку этих веществ в организме.
Американская кардиологическая ассоциация рекомендует потреблять в день 1,5 г натрия — это примерно 3/4 чайных ложки соли. Однако, согласно проведенным ими исследованиям, средний американец съедает примерно полторы, превышая норму в два раза. То же самое обнаружили и диетологи Австралии.
2. Негативные последствия избытка соли
Многочисленные исследования врачей показали, что переедание соли способствует развитию гипертонии, что, в свою очередь, может привести к инфарктам и инсультам. В 2020 году учёные заявили, что увеличение ежедневного употребления натрия всего на 1 г приводит к повышению риска смерти от сердечно-сосудистых заболеваний на 6%. Кровяное давление влияет и на здоровье почек, поэтому сильно солёная пища может отрицательно сказаться и на них.
Впрочем, на этот счёт учёные пока не смогли прийти к единому мнению. Некоторые из них считают, что доказательств влияния потребления соли на кровяное давление недостаточно. В любом случае паниковать и полностью отказываться от соли не стоит: доказано, что употребление в пределах одной-двух чайных ложек точно не способствует повышению давления.
Кроме того, обзор 2014 года показал, что сокращение количества соли в рационе на 2 г способствует снижению систолического артериального давления всего на 3,82 мм ртутного столба. При средних значениях в 125–144 мм ртутного столба такое снижение представляется не особенно значимым.
Между делом учёные выяснили, что одни люди более чувствительны к соли, чем другие. Вероятно, именно им стоит более пристально следить за соблюдением нормы потребления натрия. Но зато и сокращение соли в рационе для них будет более эффективным, чем для тех, кто не так чувствителен. В группу риска, по мнению учёных, входят пожилые люди, гипертоники, афроамериканцы, люди с хроническими заболеваниями почек, те, у кого был низкий вес при рождении.
3. Соль и рак желудка
Некоторые исследования связывают диеты с повышенным содержанием соли с риском развития рака желудка. Так, одно из исследований, проведённых в Японии, с участием более чем 40 000 человек показало, что этот риск выше аж на 30% у тех, кто предпочитает сильно солёную пищу.
При этом учёные пока не пришли к единому мнению, как конкретно соль может вызвать рак. По одной из версий, она способствует размножению бактерий, провоцирующих язвенную болезнь, которая может перерасти в рак. По другой — диета с высоким содержанием соли может вызвать клеточные мутации, которые в конечном счёте и приводят к раку.
4. Остеопороз
Ещё одна опасность избыточного потребления соли — остеопороз. Организм выводит излишки натрия через мочу, а вместе с ней выводится и кальций. Соответственно, чем больше соли необходимо вывести организму, тем больше он вымоет и кальция, что может стать причиной костных нарушений.
5. Контроль количества потребляемой соли
Ограничивать соль в рационе действительно есть смысл, поскольку следить за ее количеством не так просто, особенно если вы употребляете готовые продукты, например соусы. Соль содержится практически во всех продуктах питания, но оценить её количество не всегда можно на глаз.
Роспотребнадзор приводит таблицу содержания соли в различных продуктах. По их данным, в 100 г среднесолёной сельди содержится 336% дневной нормы натрия, в 100 г пармезана — 106%, а в таком же количестве оливок — 97%. Таким образом, чтобы не превысить норму, вам не только нужно выбрать в день что-то одно, но и совсем не употреблять соль в других продуктах, что практически невозможно.
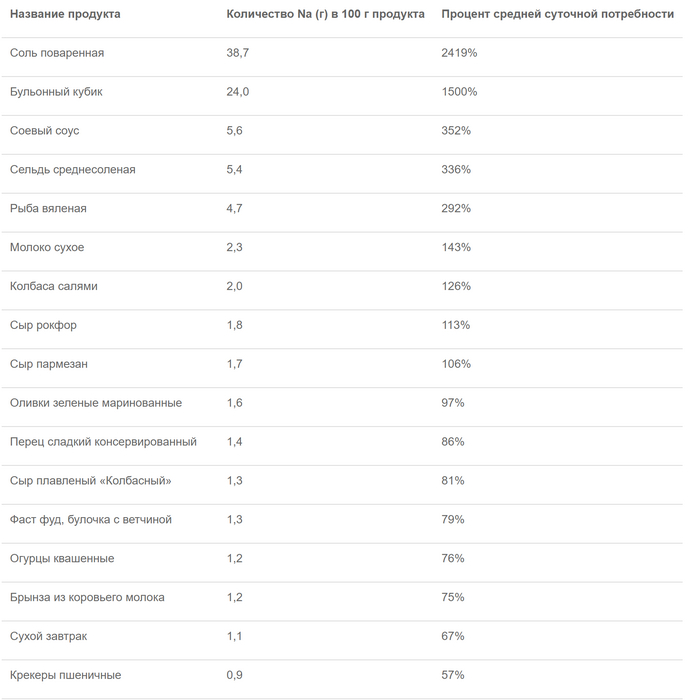
Таким образом, избыточное потребление соли может быть опасно для здоровья, хотя учёные до сих пор не смогли прийти к единому мнению на этот счёт. Тем не менее полностью отказываться от неё нельзя, поскольку она — источник натрия, который необходим организму для нормальной жизнедеятельности, а его нехватка может привести к печальным последствиям для здоровья.
Поэтому, как и со многими другими продуктами, с солью всё хорошо в меру, однако утверждать, что её употребление в любых количествах приближает смерть, — несправедливо.

Наш вердикт: полуправда (проверяемый факт или утверждение представляет собой смесь правды и лжи примерно в равных пропорциях)
Ещё нас можно читать в Телеграме, в Фейсбуке и в Вконтакте
В сообществах отсутствуют спам, реклама и пропаганда чего-либо (за исключением здравого смысла).
Аудиоверсии проверок в виде подкастов c «Коммерсантъ FM» доступны в Simplecast, «Яндекс.Подкасты», Apple Podcasts, «ЛитРес», Soundstream и Google.Подкасты.
Читайте также:
