Хлор получают в вытяжном шкафу
Обновлено: 17.05.2024
Получение газообразного хлора должно осуществляться, как правило, с использованием испарителей. В качестве испарителей должны использоваться преимущественно проточные теплообменные аппараты. Применение объемных испарителей допускается только при соответствующем техническом обосновании и согласовании с Госгортех-надзором России. [1]
Для получения газообразного хлора требуется устройство обогреваемого испарителя. Несколько хлорных баллонов устанавливают на весах в вытяжном шкафу и соединяют через коллектор с испарителем хлора. Жидкий хлор, выходящий из баллонов, поступает в теплообменник, где испаряется за счет тепла, подводимого с теплоносителем и в газообразном состоянии подается на осушку. [3]
Для получения газообразного хлора баллон устанавливается вниз вентилем, и тогда из баллона при открывании вентиля будет выходить газообразный хлор. [4]
Для получения газообразного хлора 3 г КМпО4 помещают в чашку Петри, растворяют в 50 мл воды, переносят чашку в эксикатор, добавляют 3 - 5 мл концентрированной соляной кислоты. [5]
При использовании в процессе получения АК газообразного хлора он поступает к установке в необходимых количествах по хлоропроводу, передозирование его, даже на 50 %, вызывает небольшое изменение рН золя ( рис. 32, кривая /) и скорость застудневания изменяется не так резко ( возможность мгновенного застудневания исключена); при хранении перемешивание золя не требуется. [6]
При использовании в процессе получения АК газообразного хлора он поступает к установке в необходимых количествах по хлоропроводу. Передозирование его, даже на 50 %, вызывает небольшое изменение рН золя ( рис. 45, кривая 2) и скорость застудневания изменяется не так резко ( возможность мгновенного застудневания исключена); при хранении перемешивание золя не требуется. При обработке высокоцветных вод такой золь наиболее эффективен [76] в связи с тем, что в качестве побочного продукта при его приготовлении образуется гипохлорит натрия, обладающий высокими окислительными и бактерицидными свойствами. Это позволяет не учитывать стоимость хлора, затраченного на активирование, так как в конечном счете он будет израсходован на обеззараживание воды и окисление ее примесей. Количество хлора, вводимое в воду с АК ( - 0 25 мг / мг Si02) может быть вычтено из его дозы при хлорировании. [8]
Жидкий хлор, применяемый для получения газообразного хлора , используемого в хлорорганическом синтезе, например в производстве хлористого аллила, эпихлоргидрина, перхлоруглеродов, должен содержать ( частей на миллион): не более 50 влаги и не более 20 кислорода. Указанные требования к качеству хлора обеспечиваются дополнительной осушкой его от влаги 96 - 98 % - ной серной кислотой и очисткой от кислорода термическим способом. [9]
Некоторая часть жидкого хлора расходуется в цехах сжижения на испарение с целью получения чистого газообразного хлора . Основное количество сжиженного хлора передается потребителям. Для транспортирования хлора на небольшие расстояния в пределах одного завода обычно применяется трубопровод жидкого хлора. [10]
К ним относятся электролитические установки для приготовления растворов гипохлорита натрия и установки для получения газообразного хлора . Рассмотрим наиболее совершенные установки всех трех типов. [12]
Электролитические методы получения металлов ( алюминия, магния) из солевых расплавов, получение газообразного хлора и раствора щелочи электролизом растворов поваренной соли, производство персульфата, перхлората и перманганата, окисление и восстановление органических веществ ( получение йодоформа, электрохлорирование бензола, электровосстановление нитробензола) и многие другие технические применения электролиза приобретают все большее значение. [13]
Запрещается использование железнодорожных цистерн и контейнеров ( бочек) в качестве объемных испарителей жидкого хлора для получения газообразного хлора . [14]
Поскольку на станцию поступает жидкий хлор, его нужно испарить в баллонах, бочках или в испарителях для получения газообразного хлора . Количество хлора, испаряющегося в баллонах и бочках без подогрева, зависит от температуры воздуха в хлораторной. Процесс испарения хлора в баллонах может быть ускорен их обогревом. [15]
Готовься к ЕГЭ в Тик-Ток формате
"Незнайка" и "Решу ЕГЭ" запускают свои курсы подготовки. Короткие видео, много практики и нереальная польза!

Вариант 26
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
Атомы химических элементов, находящиеся в одной группе в главной подгруппе, имеют одинаковое(-ые)
1) число электронов
2) заряды ядер атомов
3) число валентных электронов
4) число электронов на предпоследнем уровне
Наибольшей окислительной активностью обладает
Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
В каких соединениях атомы углерода и азота имеют одинаковое значение степени окисления?
К кислотным оксидам относится
2) оксид азота(II)
Окислительно-восстановительной реакцией не является
При полной диссоциации 1 моль фосфата калия в растворе образуется
1) 3 моль катионов калия и 4 моль фосфат-анионов
2) 2 моль катионов калия и 3 моль фосфат-анионов
3) 1 моль катионов калия и 3 моль фосфат-анионов
4) 3 моль катионов калия и 1 моль фосфат-анионов
Сокращённое ионное уравнение Н + + ОН - = Н2O соответствует реакции
Практически осуществима реакция
Оксид меди(II) взаимодействует с
При взаимодействии железа с концентрированной азотной кислотой при обычных условиях преимущественно образуются
1) нитрат железа(III), водород
2) вещества не взаимодействуют
3) оксид азота(IV), нитрат железа(III), вода
4) оксид азота(I), нитрат железа(II), вода
Какая схема соответствует разложению нитрата меди(II) при нагревании?
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Получать хлор необходимо в вытяжном шкафу
Б. При работе с растворами едких веществ необходимо надевать защитные перчатки и очки.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Процесс окисления отражён схемой
На какой диаграмме распределение массовых долей элементов отвечает качественному составу гидроксокарбоната магния?
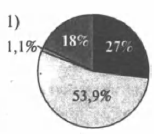
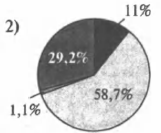
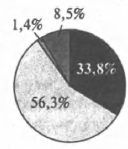
3)

В ряду элементов О → S → Se:
1) все элементы имеют высшую степень окисления, равную номеру группы
2) уменьшается прочность водородных соединений
3) увеличивается высшая степень окисления
4) уменьшается сила гидроксидов, образованных высшими оксидами
5) ослабевают неметаллические свойства
2) может взаимодействовать с глицерином
3) преимущественно входит в состав растительных жиров
4) хорошо растворяется в воде
5) взаимодействует с хлоридом натрия
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
А) КОН(р-р) и HCl(p-p)
Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
А) оксид железа(II)
Часть 2.
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
H2S -2 + Fe +3 Cl3 → S 0 + HCl + Fe +2 Cl2
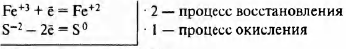
2Fe +3 + S -2 = 2Fe +2 + S 0
Fe +3 (Fe +3 Cl3) — окислитель
S -2 (H2S -2 ) — восстановитель
Определите объёмную долю аммиака в газовой смеси его с воздухом, если известно, что на нейтрализацию 150 л (н.у.) этой смеси было израсходовано 2,913 л 4,9 %-ного раствора серной кислоты плотностью 1,03 г/мл (продукт реакции — средняя соль).
1) Составляем уравнение реакции:
2) Рассчитываем количество вещества серной кислоты:
3) По уравнению реакции:
4) Рассчитываем объёмную долю аммиака в смеси:
ρ(NH3) = 67,2/150 = 0,448, или 44,8%.
Даны вещества: АlСl3, CuSO4, 5H2O, Ba(NO3)2, НСl, Н2O2, Аl. Используя воду и необходимые вещества только из этого списка, получите в две стадии нитрат алюминия. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
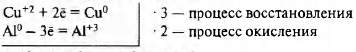
2Аl 0 + 3Cu 2+ = 2Аl 3+ + ЗСu 0
Cu +2 (CuSO4) — окислитель
Аl 0 — восстановитель
Реакция окислительно-восстановительная. Алюминий растворяется, выделяется медь красного цвета.
Реальный вариант ОГЭ по химии — 2021 № 5
Реальный вариант ОГЭ по химии-2021. Реальный КИМ ОГЭ по химии 2021 с ответами и решениями.
В 2021 году централизованный ОГЭ по химии отменили. Вместо этого провели контрольные работы в формате ОГЭ. Но КИМ остались те же самые (не пропадать же им).
Вариант 5
Часть 1
1. Выберите два утверждения, в которых говорится о железе как о химическом элементе.
1) Железная окалина состоит из железа и кислорода.
2) Оцинкованное железо устойчиво к атмосферным осадкам.
3) Железо выплавляют из природных руд.
4) Железо реагирует с кислородом.
5) В состав пирита входит железо.
2. На рисунке изображена модель строения ядра атома некоторого химического элемента.

Запишите в таблицу номер периода (Х) и номер группы (Y), в которой данный химический элемент расположен в Периодической системе Д.И. Менделеева. (Для записи ответа используйте арабские цифры.)
3. Расположите химические элементы:
1) кремний 2) азот З) сера
в порядке увеличения электроотрицательности их атомов.
Запишите номера элементов в соответствующем порядке.
4. Установите соответствие между формулой вещества и степенью окисления фосфора в этом веществе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | СТЕПЕНЬ ОКИСЛЕНИЯ ФОСФОРА |
| А) AlPO4 | 1) 0 |
| Б) P4 | 2) -3 |
| В) Ca3P2 | 3) +4 |
| 4) +5 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
5. Из предложенного перечня выберите два вещества, содержащие ковалентную полярную связь.
6. Какие два утверждения верны для характеристики как кислорода, так и хлора?
1) Соответствующее простое вещество газообразно при обычных условиях.
2) Является металлом.
3) Химический элемент в соединениях с водородом проявляет отрицательную степень окисления.
4) Химический элемент не образует летучего водородного соединения.
5) Высшая валентность этого элемента равна VII
7. Из предложенного перечня веществ выберите кислотный оксид и оснóвный оксид,
Запишите в поле ответа сначала номер кислотного оксида, а затем номер основного оксида.
8. Какие два из перечисленных веществ вступают в реакцию c оксидом меди (II) ?
9. Установите соответствие между реагирующими веществами и возможными продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ |
| А) CO2 и NaOH | 1) Na2CO3 и H2O |
| Б) HNO2 и NaOH | 2) NaNO2 и H2O |
| В) N2O5 и NaOH | 3) Na2CO3 и H2 |
| 4) NaNO3 и H2O | |
| 5) NaNO3 и H2 |
10. Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) алюминий | 1) Zn(OH)2, AgNO3 |
| Б) соляная кислота | 2) Ca, HNO3 |
| В) сульфат аммония | 3) KOH, HCl |
| 4) Ca(OH)2, BaCl2 |
11. Из предложенного перечня выберите две пары веществ, между которыми протекает реакция замещения.
1) магний и нитрат железа (III)
2) оксид серы(VI) и оксид железа(III)
3) оксид меди(II) и соляная кислота
3) алюминий и хлор
5) кальций и вода
12. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) FeCl3 и NaOH | 1) выпадение белого осадка |
| Б) CuCl2 и Na2S | 2) выпадение бурого осадка |
| В) FeSO4 и BaCl2 | 3) выпадение черного осадка |
| 4) выпадение голубого осадка |
Запишите таблицу выбранные цифры под соответствующими буквами.
13. При полной диссоциации 1 моль каких двух из представленных веществ в качестве катионов образуются только ионы водорода?
14. Выберите два исходных вещества, взаимодействие которых соответствует сокращенное ионное уравнение реакции.
15. Установите соответствие между схемой процесса, происходящего в окислительно — восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
| СХЕМА ПРОЦЕССА | НАЗВАНИЕ ПРОЦЕССА |
| А) P -3 → P +5 | 1) окисление |
| Б) Mn +6 → Mn +4 | 2) восстановление |
| В) Br2 0 → 2Br +5 |
16. И перечисленных суждений о правилах работы с веществами в лаборатории и быту выберите верное(-ые) суждение(-я).
1) Для измельчения твердых веществ используют ступку.
2) Взаимодействие раствора серной кислоты и щелочи проводят без использования вытяжного шкафа
3) Раствор медного купороса для опрыскивания растений можно готовить в оцинкованной посуде.
4) При получении кислорода термическим разложением перманганата калия необходимо использовать защитные очки.
Запишите в поле ответа номер(-а) верного(-ых) суждения(-ий).
17. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) H2SO4 и Li2SO4 | 1) Fe |
| Б) ZnSO4 и MgCl2 | 2) NaOH |
| В) Na2CO3 и K3PO4 | 3) HCl (р-р) |
| 4) фенолфталеин |
18. Вычислите массовую долю (в процентах) кальция в гидрофосфате кальция. Запишите число с точностью до десятых.
19. Вычислите массу гидрофосфата кальция (в миллиграммах), которую должна содержать одна таблетка витаминно — минерального комплекса, если рекомендован прием двух таблеток в сутки. Запишите число с точностью до целых.
Часть 2
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Zn 0 — восстановитель
HNO3 — окислитель за счет N +5
21. Дана схема превращений:

Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьей реакции составьте сокращённое ионное уравнение.
22. К раствору карбоната калия массой 27,6 г и массовой долей соли 10% прилили избыток раствора нитрата магния. Вычислите массу образовавшегося осадка. В ответ запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения
искомых физических величин.)
m(MgCO3) = 0,02 * 84 = 1,68 г
Практическая часть
23. Запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства хлорида алюминия, и укажите признаки их протекания. Используйте только вещества из приведенного выше перечня
Дан раствор хлорида алюминия, а также набор следующих реактивов: железо, растворы аммиака, серной кислоты, гидроксида натрия, нитрата серебра.
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl выпадение белого студенистого осадка
AlCl3 + 3AgNO3 = 3AgCl↓ + Al(NO3)3 выпадение белого творожистого осадка
Сообщите организатору в аудитории о своей готовности приступить к выполнению задания 24.
24. Проведите химические реакции между хлоридом алюминия и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведенные в инструкции
к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его.
Инструкция по выполнению задания 24
1. Вы приступаете к выполнению задания 24. Для этого получите лоток с лабораторным оборудованием и реактивами у специалиста по обеспечению лабораторных работ в аудитории.
2. Прочтите ещё раз перечень веществ, приведённый в тексте к заданиям 23 и 24, и убедитесь (по формулам на этикетках) в том, что на выданном лотке находится пять указанных в перечне реактивов. При обнаружении
несоответствия набора веществ на лотке перечню веществ в условии задания сообщите об этом организатору в аудитории.
3. Перед началом выполнения эксперимента осмотрите ёмкости с реактивами и продумайте способ работы с ними. При этом обратите внимание на рекомендации, которым Вы должны следовать.
3.1 В склянке находится пипетка. Это означает, что отбор жидкости и переливание её в пробирку для проведения реакции необходимо проводить только с помощью пипетки. Для проведения опытов отбирают 7–10 капель реактива.
3.2 Пипетка в склянке с жидкостью отсутствует. В этом случае переливание раствора осуществляют через край склянки, которую располагают так, чтобы при её наклоне этикетка оказалась сверху («этикетку – в ладонь!»). Склянку медленно наклоняют над пробиркой, пока нужный объём раствора не перельётся в неё. Объём
перелитого раствора должен составлять 1–2 мл (1–2 см по высоте пробирки).
3.3 Для проведения опыта требуется порошкообразное (сыпучее) вещество. Отбор порошкообразного вещества из ёмкости осуществляют только с помощью ложечки или шпателя.
3.4 При отборе исходного реактива взят его излишек. Возврат излишка реактива в исходную ёмкость категорически запрещён. Его помещают в отдельную, резервную пробирку.
3.5 Сосуд с исходным реактивом (жидкостью или порошком) обязательно закрывается крышкой (пробкой) от этой же ёмкости.
3.6 При растворении в воде порошкообразного вещества или при перемешивании реактивов следует слегка ударять пальцем по дну пробирки.
3.7 Для определения запаха вещества следует взмахом руки над горлышком сосуда направлять на себя пары этого вещества.
3.8 Если реактив попал на рабочий стол, кожу или одежду, необходимо незамедлительно обратиться за помощью к специалисту по обеспечению лабораторных работ в аудитории.
Реальный вариант ОГЭ по химии — 2021 № 4
Вариант 4
Часть 1
1. Выберите два утверждения, в которых говорится о хлоре как о простом веществе:
1) Поваренная соль содержит хлор.
2) Хлор — сильный окислитель.
3) Хлор реагирует даже с золотом
4) Хлор входит в состав минерала галита.
5) В хлориде железа(III) по сравнению с хлоридом железа(II) содержится больше хлора.
2. На рисунке изображена схема распределения электронов по электронным слоям атома некоторого химического элемента.
Запишите в таблицу номер периода (X) и номер группы (Y), в которой данный химический элемент расположен в Периодической системе Д.И. Менделеева. (Для записи ответа используйте арабские цифры).
1) кислород 2) кремний З) азот
в порядке уменьшения радиусов их атомов.
4. Установите соответствие между формулой вещества и степенью окисления марганца в данном веществе: к каждой позиции, обозначенной буквой подберите соответствующую позицию, обозначенную цифрой.
5. Из предложенного перечня выберите два вещества с ионной связью.
6. Какие два утверждения верны для характеристики как алюминия, так и бора?
1) Все электроны в атоме элемента в основном состоянии находятся на трёх энергетических уровнях.
2) Атомный радиус элемента больше атомного радиуса лития.
3) Электроотрицательность меньше, чем у углерода,
4) Образуемый элементом высший оксид относится к кислотным.
5) Элемент образует высший оксид состава Э2О3
7. Из предложенного перечня веществ выберите основание и двухоснóвную кислоту
Запишите в поле ответа сначала номер основания, а затем номер двухоснóвной кислоты.
8. Какие два из перечисленных веществ вступают в реакцию с оксидом железа(II)?
9. Установите соответствие между реагирующими веществами и продуктом(-ами) их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(Ы) ВЗАИМОДЕЙСТВИЯ |
| А) Al + KOH + H2O → | 1) → KAlO2 |
| Б) AlCl3(изб.) + KOH → | 2) → KAlO2 + H2 |
| В) AlCl3 + KOH(изб) → | 3) → K[Al(OH)]4 + KCl |
| 4) → Al(OH)3 + KCl | |
| 5) → K[Al(OH)]4 + H2 |
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) C | 1) HCl, CuSO4 |
| Б) Cl2 | 2) KOH, H2 |
| В) Fe | 3) Al2O3, NaCl |
| 4) CuO, O2 |
11. Из предложенного перечня выберите две пары веществ, между которыми протекает реакция соединения.
2) оксид серы (VI) и оксид кальция
3) оксид меди (II) и соляная кислота
4) железо и хлор
12. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) CuSO4 и BaCl2 | 1) выпадение белого осадка |
| Б) CuSO4 и NaOH | 2) выпадение желтого осадка |
| В) FeSO4 и NaOH | 3) выпадение голубого осадка |
| 4) выпадение серо — зеленого осадка |
13. При полной диссоциации 1 моль каких двух из представленных веществ образуется 3 моль ионов?
1) сульфат железа(III)
2) бромид меди(II)
3) нитрат хрома(III)
4) гидроксид кальция
5) хлорид аммония
14. Выберите два исходных вещества, взаимодействию которых соответствует сокращенное ионное уравнение реакции
| СХЕМА ПРОЦЕССА | НАЗВАНИЕ ПРОЦЕССА |
| А) 2O -2 → O2 0 | 1) окисление |
| Б) Cr +6 → Cr +3 | 2) восстановление |
| В) Cl -1 → Cl +1 |
16. Из перечисленных суждений о правилах работы с веществами и оборудованием в лаборатории и быту выберите верное(-ые) суждение(-я).
1) Пробиркодержатель закрепляют в нижней части пробирки.
2) При отборе избытка раствора соляной кислоты запрещается возвращать его в исходную ёмкость.
3) При использовании в быту чистящих растворов, содержащих едкий натр, необходимо использовать защитные перчатки.
4) Перемешивание растворов, находящихся в пробирке, осуществляют лёгким постукиванием пальцев по нижней части пробирки.
Запишите в поле ответа номер(а) верного(-ых) суждения(-й).
17. Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) KCl и NH3 | 1) HI |
| Б) Al(NO3)3 и KNO3 | 2) Na3PO4 |
| В) BaBr2 и Na2SO4 | 3) фенолфталеин |
| 4) HNO3(разб.) |
18. Вычислите массовую долю (в процентах) фосфора в дигидроортофосфате калия, Запишите число с точностью до десятых.
19. Вычислите массу (в граммах) фосфора, который будет внесён в составе этого удобрения в почву на участке площадью 400 м 2 . Запишите число с точностью до целых.
Часть 2
2I — -2e→ I 2 0 восстановитель
N +3 +1e → N +2 окислитель
HNO2 (за счет N +3 ) — окислитель
HI (за счет I — ) — восстановитель
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
22. К 250 г раствора карбоната натрия добавляли раствор хлорида бария до прекращения выделения осадка. Масса отфильтрованного и высушенного осадка составила 39,4 г. Рассчитайте массовую долю карбоната натрия в исходном растворе.
В ответе запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
n(BaCO3) = 39,4 / 197 = 0,2 моль
23. Запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства хлорида аммония, и укажите признаки их протекания. Используйте только вещества из приведенного выше перечня.
NH4Cl + AgNO3 = NH4NO3 + AgCl↓ выделение белого осадка
NH4Cl + KOH = NH3↑+ H2O + KCl выделение газа
Сообщите организатору в аудитории о своей готовности приступить к выполнению задания 24.
24. Проведите химические реакции между хлоридом аммония и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции
к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его.
Химическая кунсткамера
Хлораты, или триоксохлораты(V), – соли хлорноватой кислоты HClO3, триоксохлората(V) водорода. HClO3 не выделена в индивидуальном состоянии и существует только в виде водного раствора. Выпаривание раствора хлорноватой кислоты – дело опасное: как только содержание HClO3 достигает 40% по массе, она разлагается со взрывом, выделяя хлор Cl2, кислород O2 и образуя воду:
Тщательно очищенный хлорат калия KClO3 плавится при 370 °С; если его нагреть выше этой температуры, то он разлагается до хлорида калия KCl и перхлората калия KClO4:
Примеси оксидов металлов (типа MnO2, Cr2O3, CuO) не только снижают температуру разложения хлората калия, но и направляют его по другому пути. Соль распадается, выделяя кислород O2 и превращаясь в хлорид калия KCl:
В 1786 г. французский химик Клод Бертолле обнаружил, что если через водный раствор гидроксида калия KOH пропускать хлор, то выпадают кристаллы нового вещества – «бертолетовой соли». Так называли вещество с формулой KClO3, которое теперь мы знаем под названием «хлорат калия». В дальнейших опытах нам понадобятся его кристаллы. Поэтому, следуя Бертолле, рассмотрим самый простой способ получения этой соли.
В колбу наливают концентрированный водный раствор гидроксида калия, подогревают до 70–80 °С и пропускают в него ток газообразного хлора с такой скоростью, чтобы можно было считать пузырьки газа. Совершенно очевидно, что опыт надо проводить в вытяжном шкафу при хорошей вентиляции: хлор – вредный и опасный газ. Для получения хлора подойдет любой из известных по школьному учебнику способов, например взаимодействие оксида марганца(IV) с концентрированной соляной кислотой HCl:
или реакция концентрированной соляной кислоты HCl с кристаллическим перманганатом калия KMnO4:
Пропускание хлора приводит к выделению в растворе KOH бесцветных кристаллов хлората калия KClO3. Как только эти кристаллы перестанут выделяться, подачу хлора прекращают и охлаждают реакционную смесь. Затем отделяют выпавшие кристаллы фильтрованием, промывают их на фильтре небольшим количеством ледяной воды и высушивают между листами фильтровальной бумаги при комнатной температуре. Хранить хлорат калия следует в закрытой склянке, смочив кристаллы небольшим количеством воды.
Реакция получения KClO3 по способу Бертолле описывается уравнением:
Сухой хлорат калия KClO3 – опасное в обращении вещество, особенно при контакте с органическими веществами и разного рода восстановителями.
Взрывчатые свойства KClO3 Бертолле обнаружил случайно. Он начал растирать сухие кристаллы соли в ступке, в которой на стенках, как потом выяснилось, были почти незаметные следы серы, оставшиеся от других опытов. Вдруг раздался сильный хлопок, пестик вырвался из рук Бертолле, лицо его было обожжено. Так с риском для жизни Бертолле впервые осуществил реакцию, которую много позже станут применять в так называемых «шведских» спичках:
Бертолле отличало непостоянство характера, он был неравнодушен к почестям, беспринципен и тщеславен. Тем не менее, будучи талантливым ученым, он вошел в историю как автор многих химических открытий. Его считали другом Лавуазье, однако он не потрудился защитить того от преследования и казни, хотя и был членом революционного комитета Франции.
В 1807 г. Бертолле, оставив официальную службу, поселился в парижском предместье Аркей, где создал свою химическую лабораторию и основал Аркейское научное общество, в состав которого входили самые выдающиеся ученые Франции.
Гексахлорэтан (перхлорэтан) C2Cl6 – бесцветное кристаллическое вещество с «камфорным» запахом, негорючее и невзрывчатое. Нагретый водно-спиртовой раствор гидроксида калия превращает C2Cl6 в соль щавелевой кислоты – оксалат калия K2C2O4, одновременно образуется хлорид калия KCl:
При нагревании C2Cl6 выше 180 °С он возгоняется.
Перхлораты, или тетраоксохлораты(VII), – это соли хлорной кислоты HClO4, тетраоксохлората(VII) водорода. HClO4 – сильная кислота, в водном растворе подвергается протолизу и целиком превращается в катионы оксония H3O + и перхлорат-ионы ClO4 – :
Перхлораты щелочных и щелочно-земельных металлов – бесцветные кристаллические вещества, умеренно растворимые в воде. При нагревании некоторые из них, например перхлорат калия KClO4, разлагаются еще до плавления:
Перхлорат аммония NH4ClO4 при нагревании превращается в смесь газов – хлора Cl2, оксида диазота N2O, кислорода O2 и водяного пара:
Свои окислительные свойства перхлораты проявляют при нагревании их кристаллов с твердыми восстановителями, например с сульфидом калия K2S:
4.2. Когда парафин дымит?
Горения без пламени можно добиться, используя катализатор, например, оксид хрома(III) Cr2O3. Это зеленый порошок, который входит в состав многих дешевых красок в качестве пигмента.
Опыт показывают так: на керамическую плитку ставят металлическую чашку, куда накапывают от горящей свечи немного парафина, стеарина или воска, и сразу же, пока он не остыл, насыпают на него горкой зеленый порошок Cr2O3. Надо, чтобы расплавленный парафин пропитал порошок только снизу, а верхний слой Cr2O3 остался сухим. Теперь, если поднести к вершине горки зажженную спичку, начнется обильное выделение дыма, но пламени не будет.
В реакции взаимодействия парафина с кислородом воздуха с образованием CO2 и воды выделяется много теплоты, поэтому парафин постепенно плавится и под действием капиллярных сил поднимается к вершине горки. Одновременно с окислением часть парафина испаряется и, попав в холодный воздух, снова затвердевает. При этом образуется дым, который содержит частички твердого парафина и продукт его неполного сгорания – сажу.
Парафины – распространенное название алифатических углеводородов (алканы), в молекулах которых атомы углерода соединены между собой одинарными химическими связями и образуют цепи. Такие соединения называют еще насыщенными, или предельными. Самые простые из них, как известно, – метан и этан, а общая формула соединений этого ряда CnH2n+2.
Парафин (в обиходном смысле слова) – смесь предельных углеводородов с числом атомов углерода в молекуле от 18 до 35, иначе говоря, смесь соединений с составом от C18H38 до C35H72. Это бесцветное легкоплавкое вещество, практически нерастворимое в воде, оно легко возгоняется и загорается.
Если не считать горючести парафина, в остальном его химические свойства свидетельствуют об его инертности по отношению к большинству обычных реагентов – кислотам, щелочам, растворам окислителей и восстановителей. Однако стоит упомянуть об одном довольно курьезном случае, когда парафин, обычно инертный, оказался участником неожиданной реакции.
Однажды на лекции демонстрировался опыт: плавление серы в пробирке. Вдруг все почувствовали отвратительный запах. Лекция была сорвана. «В чем же дело?» - недоумевал профессор. Все оказалось просто: в пробирку с серой попали кусочки парафина.
Смесь парафина и серы при нагревании выделяет сероводород H2S и сажу. Чем сильнее нагревать эту смесь, тем в большем количестве будет происходить выделение сероводорода – не только дурно пахнущего, но и ядовитого газа. Но стоит только прекратить нагревание, как реакция останавливается.
Этот способ получения сероводорода рекомендуют использовать в лабораториях, если требуется небольшое его количество.
Читайте также:
