Конформации кресло и ванна
Обновлено: 14.05.2024
Наиболее выгодной является конформация «кресла», так как в ней полностью отсутствует угловое напряжение.
Каждый атом углерода в циклогексановом кольце может иметь два заместителя: в аксиальном (а) и экваториальном (е) положениях.
Аксиальные заместители (а) располагаются вверх и вниз параллельно оси симметрии.
Экваториальные заместители (е) расположены под углом 109º28´ к оси симметрии в направлении к периферии от молекулы.
Наиболее энергетически выгодным является экваториальное расположение заместителей в циклогексановом кольце, так как при этом отсутствует торсионное напряжение.
При аксиальном расположении заместителей возникают 1,3 диаксиальные взаимодействия, что ведет к возникновению торсионного напряжения и образованию термодинамически менее устойчивых соединений.
1.8. Классификация реагентов и органических реакций.
Реакционная способность – способность вещества вступать в ту или иную химическую реакцию и реагировать с большей или меньшей скоростью.
Реакционный центр – атом или группа атомов в молекуле, непосредственно участвующие в химической реакции.
Субстрат – вещество, подвергающееся изменениям в результате химической реакции.
Реагент – партнер субстрата и более простое вещество.

Типы реагентов и характер изменения связей
в реакционном центре субстрата
Кислотные реагенты (кислоты) – доноры протона по отношению к реакционному партнеру: частично или нацело ионизированные в водных растворах нейтральные молекулы (HCl, CH3COOH) или положительно заряженные частицы (NH4 + , H3O + ).
Основные реагенты (основания) – акцепторы протона по отношению к реакционному партнеру. Отрывают протон от кислотного центра:
отрицательно заряженные частицы B(ASE) - HO - , CH3O -
или нейтральные молекулы B: – NH3 , H2O.
Нуклеофильные реагенты (нуклеофилы) – частицы, образующие новую ковалентную связь за счет своей электронной пары.
- обладают повышенной электронной плотностью, взаимодействуют с любым атомом (кроме водорода), несущим частичный или полный положительный заряд;
- нуклеофил заряжен отрицательно (Nu - , Cl - , HO - , CH3O - , R3C - - карбоанион) или имеет неподеленную пару электронов (Nu, NH3 , H2O) или π-связь CH2= CH2, C6H6.
Электрофильные реагенты (электрофилы) – частицы, образующие новую ковалентную связь за счет пары электронов партнера.
- взаимодействуют с реакционным центром партнера с повышенной электронной плотностью;
- имеют атом, несущий частичный или полный положительный заряд или обладают вакантной орбиталью.
Радикальные реагенты (радикалы) – свободные атомы или частицы с неспаренным электроном (парамагнитные частицы).
R• – Cl•, Br•, HOO•, R•, •O–O• (бирадикал)
| Окислители – нейтральные молекулы или ионы, принимающие электроны или атомы водорода от органического субстрата. [O] (или Ox) – O2, Fe 3+ , органические окислители | Восстановители – нейтральные молекулы или ионы, отдающие электроны или атомы водорода органическому субстрату. [H] (или Red) – Р2, Fe 2+ , Н - , органические восстановители |


| реакционный центр кислотный, реагент основный | реакционный центр основный, реагент кислотный |

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
Конформации циклических углеводородов
Угловое (Байеровское) напряжение – это увеличение энергии молекулы в результате отклонения угла геометрической фигуры от идеальной величины – идеального угла в 109,5°, что и обусловливает нестабильность молекулы.
[угловое напряжение у циклопропана, (конф14)]
Первую попытку объяснить устойчивость циклов особенностями их строения сделал в 1885г. А.Байер. В основу своей теории напряжения автор положил тетраэдрическую модель атома углерода. Всякое отклонение валентных связей от нормального расположения (109,5°) создает «напряжение» в углеродной цепи молекулы, а, следовательно, понижает ее устойчивость. Напряжение определяют как разность между тетраэдрическим углом и углом геометрической фигуры, образованной атомами углерода в соответствующем цикле.
Торсионное (поворотное) напряжение – это увеличение энергии молекулы в результате пребывания в заслоненной конформации – атомные группы сближены и имеют место отталкивания атомов. Это дополнительный фактор, создающий неустойчивость трехчленного цикла.
Ядро циклогексана содержится в различных биологически активных веществах – гормонах витаминах. Поэтому важно знать его конформацию в плане прогнозирования устойчивости.
Следует отметить, что согласно теории Байера у шестичленного и высших циклов устойчивость должна падать, а в действительности шестичленный цикл прочнее пятичленного. Здесь теория Байера пришла в противоречие с фактом. Это объясняется тем, что в основу Байер положил идею о плоском строении циклов, а в настоящее время установлено, что вполне плоским является только трехчленный цикл (три его точки всегда лежат в одной плоскости).
В циклогексане атомы углерода находятся в состоянии sp 3 -гибридизации, т.е. углеродные атомы имеют тетраэдрическое расположение. Если бы у циклогексана была плоская структура, действовало бы байеровское (угловое) и торсионное напряжения, и молекула была бы нестабильна, но циклогексан самый стойкий. Это связано с тем, что его молекула не плоская.
У циклогексана шесть атомов углерода находятся в разных плоскостях, что обусловливает существование нескольких энергетически выгодных конформаций. [кресло, ванна, свернутая (твист), (конф15)]
Экспериментально установлено, что наиболее стабильна конформация «кресло» (наименьшая энергия), в которой отсутствуют угловое напряжение и напряжение заслонения, т.е. углы не отклоняются от тетраэдрических, а атомы водорода соседних метиленовых групп находятся на значительном удалении друг от друга.
Если в циклогексан вводить заместители, его производные будут отличаться по стабильности, т.к. связи в циклогексане неодинаковы:
1) аксиальные – связи, направленные вверх и вниз от плоскости кольца и параллельно оси симметрии
2) экваториальные – связи, расположенные радиально, под углом 190,5° к оси симметрии.
[рисунок связей с осью симметрии, (конф16)]
Заместители, расположенные экваториально, придают производному циклогексана стабильность, а расположенные аксиально дестабилизируют его.
В случае аксиального расположения заместителей возможно 1,3-диаксиальное взаимодействие, при этом атомы отталкиваются друг от друга и молекула при этом будет нестабильна. С увеличением объемности заместителей и их числа, как правило, их расположение всегда экваториально. (конф17)
Химические свойства. Уже само название «циклоалканы» говорит о свойствах соединений
Уже само название «циклоалканы» говорит о свойствах соединений. Как и для алканов, для циклоалканов характерны реакции свободнорадикального замещения. Хлорирование циклогексана на свету приводит к смеси от моно- до пер-замещенных хлорциклогексанов.
Далее рассмотрены специфические реакции циклоалканов. Реакционная способность этого класса органических веществ существенно зависит от размера цикла. Вообще циклоалканы делят на 4 группы:
· с большими циклами (> С12).
Начиная с циклопентана циклоалканы не демонстрируют каких-либо особенностей химического поведения.
Иначе с малыми циклами. Циклопропан и его гомологи вступают в реакции присоединения. Говорят о «ненасышенности малых циклов».
Каталитическое гидрирование, бромирование на свету и реакция с галогеноводородами приводят к производным пропана. Свободнорадикальное хлорирование дает продукт замещения. Других реакций присоединения нет.
Циклобутан гидрируется значительно труднее, в более жестких условиях.
Объяснения имеющимся фактам различной устойчивости циклов разного размера были высказаны А. Байером (Мюнхен). В 1885 г. он предложил теорию напряжения. Сегодня она частично отвергнута, но частично может быть использована.
А. Байер заметил, что в циклоалканах валентные углы отклоняются от стандартных значений, что приводит к возникновению напряжения в циклах.
Байер выразил угловое напряжение в циклоалканах половиной разницы валентного угле и внутреннего угла многоугольника. Для циклопропана:
| 109 о 28’ – 60 o | = 24 o 44’ |
Угловое напряжение в циклобутане – 9 о 44’, в циклопентане – 0 o 44’, в циклогексане – -5 о 16’, в циклогептане – -9 о 33’. Далее, с увеличением размера цикла, напряжение растет. В XIX веке было известно о ненасыщенности малых циклов, устойчивости обычных циклов, а циклы большого размера не были получены. Считали, что их не удается получить из-за большого углового напряжения. На самом деле их просто не умели синтезировать.
Напряжение в циклах приводит к увеличению энергии (уменьшению стабильности) молекулы. Энергию циклоалканов очень удобно сравнивать по их очень точно определенным теплотам сгорания. Причем не в абсолютных величинах, а по теплоте сгорания на одно СН2-звено. Большие величины говорят о большей энергии.
Теплоты сгорания циклоалканов
| Соединение | DHCH2 (ккал/моль) |
| ациклические углеводороды | 157,4 |
| циклопропан | 166,6 |
| циклобутан | 164,0 |
| циклопентан | 158,7 |
| циклогексан | 157,4 |
| циклогептан | 158,3 |
| циклооктан | 158,6 |
| циклододекан | 157,6 |
| циклогептадекан | 157,2 |
Как видно из табл. 1, энергия сгорания циклоалканов, начиная с циклопентана, близка к значениям к энергии открытоцепных производных, не имеющих углового напряжения. Циклопропан и циклобутан действительно богаты энергией. Рассмотрим строение циклоалканов на примере циклогексана. По Байеру угловое напряжение в циклогексане больше, чем в циклопентане, хотя в реальной молекуле циклогексана углового напряжения нет. Все углы имеют стандартные значения, т.к. атомы углерода расположены не планарно (а Байер считал все циклы плоскими). Оказывается, существуют две конформации циклогексана, не имеющие углового напряжения, – «ванна» («лодка») и «кресло».
Рис. 16.1. Конформации «ванна» и «кресло» циклогексана
Эти конформации неравноценны по энергии. В конформации «ванна» флагштоковые водороды расположены слишком близко друг к другу. Они отталкиваются, искажая ванну. Кроме того, группировки по бортам «лодки» находятся в заслоненной конформации. Такие группы стремятся за счет торсионного напряжения перейти в заторможенную конформацию. Все вместе это приводит к образованию твист-конформации, которая устойчивее «ванны» на 1,5 ккал.
Рис. 16.2. твист-Конформация циклогексана
В конформации «кресло» отсутствуют флагштоковые водороды и их отталкивание. Кроме того, все СН2-группы находятся в заторможенной конформации, что дает выигрыш в энергии. Конформация «кресло» на 5,5 ккал/моль устойчивее твист-конформации и на 7 ккал/моль – «ванны».
В конформации «кресло» 6 атомов водорода перпендикулярны усредненной плоскости кольца и называются аксиальными (a-), а 6 других находятся близко к этой условной плоскости и называются экваториальными (e-). Если заместить один из водородов на алкильную или какую-нибудь функциональную группу, она может находиться в экваториальном или аксиальном положении. При комнатной температуре существует единственный циклогексан, а не два изомера. Причина этого – быстрая инверсия цикла, в результате которой метильная группа из аксиальной становится экваториальной.
Рис. 16.3. Инверсия метилциклогексана
Циклопентан по Байеру практически не имеет углового напряжения. Однако даже он существует не в планарной форме, т.к. в плоской молекуле все атомы водорода будут находиться в заслоненной конформации, что приведет к заметному торсионному напряжению. Энергетически более выгодно существование циклопентана в виде так называемого «конверта», в котором 4 атома углерода находятся в одной плоскости, а пятый выходит из нее.
Рис. 16.4. Конформационные изменения циклопентана
Циклобутан также неплоский, он представляет собой два равносторонних треугольника, соединенных по одной из сторон и располагающихся в разных плоскостях. Причина выхода двух атомов углерода из плоскости все в той же заслоненной конформации метиленовых групп, которая энергетически невыгодна.
Рис. 16.5. Конформационные изменения циклобутана
В циклопропане атомы углерода не могут находиться в разных плоскостях (геометрическое место трех точек – плоскость). Молекулу можно представить как правильный треугольник. Однако экспериментальные данные показывают, что циклопропан ведет себя так, как если бы угол между С-С связями составлял 102 о . Невозможно представить себе правильный треугольник с внутренними углами не равными 60 о .
Перекрывание атомных гибридизованных орбиталей в молекуле циклопропана показано на рис. 16.6. Как видно, связь образуется не по линии, связывающей центры атомов. Такие связи называют «банановыми» или изогнутыми. По своим характеристикам они занимают промежуточное положение между s- и p-связями. Этот факт объясняет частичную ненасыщенность циклопропана.
Рис. 16.6. Перекрывание атомных орбиталей в молекуле циклопропана
Некоторые алициклические производные широко используются в промышленности. В первую очередь это относится к производным циклогексана. Исходным сырьем для синтеза многотоннажных продуктов служит циклогексанон, получаемый в промышленности из доступного фенола.
Каталитическое гидрирование фенола приводит к смеси циклогексанола и циклогексанона, которую, без предварительного разделения, окисляют, получая циклогексанон.
Два основных направления использования циклогексанона:
1. В присутствии окислителей циклогексанон легко превращается в адипиновую кислоту, которую затем вводят в реакцию поликонденсации с гексаметилендиамином с целью получения найлона:
2. Реакция циклогексанона с гидроксиламином приводит к оксиму циклогексанона. Последний под действием серной кислоты претерпевает перегруппировку Бекмана, превращаясь в капролактам, который гидролизуют, получая e-аминокапроновую кислоту. Поликонденсация аминокапроновой кислоты приводит к капрону.
Из непредельных соединений алициклического ряда следует отметить одно вещество – циклопентадиен-1,3. Это вещество будет рассмотрено в разделе ароматические углеводороды. Здесь следует отметить следующее:
· Циклопентадиен существует в виде димера, который образуется в результате реакции Дильса-Альдера. Для получения самого циклопентадиена димер перегоняют.
· Циклопентадиен необычайно легко отдает протон (проявляет высокую кислотность), что совершенно не характерно для углеводородов (причины этого будут рассмотрены в следующем разделе).
Конформации ациклических соединений
Простейшим соединением со связью С-С является этан; рассмотрим две из множества его конформаций. В одной из них (рис. 7, а) расстояние между атомами водорода двух групп СН3 наименьшее, поэтому находящиеся друг против друга связи С-Н отталкиваются. Это приводит к увеличению энергии молекулы, а, следовательно, к меньшей устойчивости этой конформации. При взгляде вдоль связи С-С видно, что три связи С-Н у каждого атома углерода попарно «заслоняют» друг друга. Такую конформацию называют заслоненной.

Рис. 7.Заслоненная (а, б) и заторможенная (в, г) конформации этана
В другой конформации этана, возникающей при повороте одной из групп СН3 на 60° (см. рис. 7, в), атомы водорода двух метильных групп максимально удалены друг от друга. При этом отталкивание электронов связей С-Н будет минимальным, энергия такой конформации также будет минимальной. Эту более устойчивую конформацию называют заторможенной. Разница в энергии обеих конформаций невелика и составляет ~12 кДж/моль; она определяет так называемый энергетический барьер вращения.
Проекционные формулы Ньюмена.Эти формулы (проще - проекции Ньюмена) используют для изображения конформаций на плоскости. Для построения проекции молекулу рассматривают со стороны одного из атомов углерода вдоль его связи с соседним атомом углерода, вокруг которой происходит вращение. При проецировании три связи от ближнего к наблюдателю атома углерода к атомам водорода (или в общем случае - к другим заместителям) располагают в виде трехлучевой звезды с углами 120°. Удаленный от наблюдателя (невидимый) атом углерода изображают в виде круга, от которого также под углом 120° отходят три связи. Проекции Ньюмена также дают наглядное представление о заслоненной (см. рис. 7, б) и заторможенной (см. рис. 7, г) конформациях.
При обычных условиях конформации этана легко переходят друг в друга, и можно говорить о статистическом наборе различных конформаций, незначительно различающихся по энергии. Выделить в индивидуальном виде даже более устойчивую конформацию невозможно.
В более сложных молекулах замена атомов водорода при соседних атомах углерода на иные атомы или группы приводит к их взаимному отталкиванию, что сказывается на увеличении потенциальной энергии. Так, в молекуле бутана наименее выгодной будет заслоненная конформация, а самой выгодной - заторможенная конформация с максимально удаленными группами СН3. Разница между энергиями этих конформаций составляет ~25 кДж/моль.
У бутана при повороте относительно связи между вторым и третьим атомами углерода возникает дополнительно скошеннаяконформация (гош-конформация). Кроме этого, заслоненные конформации бутана отличаются энергетически.
Заслоненная (исходная) конформация бутана характеризуется максимальной энергией, что обусловлено наличием торсионных и ван-дер-ваальсовых напряжений. Ван-дер-ваальсовы напряжения в этой конформации возникают из-за взаимного отталкивания объемных (в сравнении с атомом Н) метильных групп, оказавшихся сближенными. Такое взаимодействие увеличивает энергию конформации, делая ее энергетически невыгодной. При повороте на 60° возникает скошенная конформация, в которой нет торсионных напряжений (связи не заслоняют друг друга), а ван-дер-ваальсовы напряжения существенно уменьшаются за счет отдаления метильных групп друг от друга, поэтому энергия гош-конформации меньше на 22 кДж/моль энергии заслоненной конформации. При очередном повороте на 60° возникает заслоненная конформация, в которой, однако, имеют место только торсионные напряжения. Между атомом Н и группой СН3 не возникают ван-дер-ваальсовы напряжения вследствии незначительного размера атома Н. Энергия такой конформации меньше энергии исходной заслоненной конформации на 7,5 кДж/моль. Очередной поворот на 60° приводит к возникновению заторможенной конформации, в которой нет торсионных и ван-дер-ваальсовых напряжений, так как связи не заслоняют друг друга, а объемные метильные группы максимально удалены друг от друга. Энергия заторможенной конформации минимальна, меньше энергии исходной заслоненой конформации на 25,5 кДж/моль, а по сравнению с энергией скошенной конформации меньше на 3,5 кДж/моль. Последующие повороты приводят в возникновению заслоненной, скошенной и исходной заслоненной конформаций. При обычных условиях большинство молекул бутана находятся в виде смеси гош- и анти-конформеров.
12. Конформации циклических соединений: ванна, кресло на примере (циклогексан, тетрагидропиран); их относительная потенциальная энергия. Аксиальные и экваториальные связи.
Для циклогексана, как правильного шестиугольника, межъядерные углы составляют 120º. Если бы молекула циклогексана имела плоское строение, то отклонение от нормального валентного угла атома углерода составляло:109,5º–120º = 10,5º.
Однако циклогексан и большие циклы имеют неплоское строение. В рассматриваемой молекуле циклогексана сохраняются обычные валентные углы при условии его существования в двух конформациях «кресла» и «ванны». Конформация «кресла» менее напряжена, поэтому циклогексан существует преимущественно в виде конформеров I и III, причем цикл претерпевает непрерывную инверсию (inversio – с латинского переворачивание, перестановка) с промежуточным образованием конформера II:
Двенадцать связей C–H, которые имеются у циклогексана в конформации «кресла», делятся на два типа. Шесть связей направлены радиально от кольца к периферии молекулы и называются экваториальными связями (e-связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a-связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три – в другую (имеется чередование: вверх-вниз).
Взаимное превращение этих конформаций, а также переход конформации кресла вконформацию ванныпроисходит через гибкие формы, известные под названиями полукреслаи «искаженной» ванны (твист-форма).При переходе от одной конформации к другой меняется потенциальная энергия системы. Максимум энергии соответствует конформации полукресла; минимальной энергией обладает конформация кресла.
Шестичленный цикл с атомом кислорода, тетрагидропиран, имеет конформацию кресла. Алкильные заместители во всех позициях предпочтительно занимают экваториальное положение, напротив, α-алкоксильная группа (атом галогена и т.п.) стремится занять аксиальное положение. Этот эффект носит название аномерного, и обусловлен, по крайней мере частично, неблагоприятным диполь-дипольным взаимодействием атомов кислорода, когда алкоксигруппа находится в экваториальном положении. Такой же эффект проявляют и алкоксигруппы в четвёртом положении.
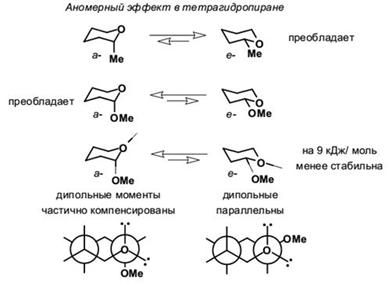
Иногда для лучшего понимания аномерного эффекта (эффект Ривса) рассматривают простые для восприятия, но не совсем корректные, проекционные формулы Ньюмена с аксильными и экваториальными неподелёнными парами атома кислорода.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
Конформации циклических соединений
Согласно теории Байера считалось, что циклические системы имеют плоскую структуру. Напряженность зависит от углового напряжения, которое определяют как разницу между тетраэдрическим углом и углом правильного многоугольника, образующего ту или иную циклическую систему.
Согласно теории Байера самой ненапряженной циклической системой является пятичленная, что противоречит экспериментальным данным. Известно,что в природе наиболее устойчивы шестичленные циклы. Т.е. теория Байера верна только для малых циклов и лишена основы для остальных циклических систем. В начале 20 века Закс и Мор высказали предположение, что циклы с числом атомов в цикле > 5 отклоняются от копланарности и сохраняют естественный угол валентности. В связи с этим оказалось возможным построить две ненапряженные модели для циклогексана - кресла и ванны
Конформация кресло Конформация ванна
В конформации кресло для циклогексана возможны два типа СН связей:
I –6 связей направлены в стороны от кольца под углом 109,5 0 , лежат примерно в в его плоскости и их называют экваториальными (е).
II – 6 связей параллельны оси симметрии и направлены попеременно вверх – вниз, перпендикулярны плоскости кольца получили название – аксиальные (а). Для циклогексана возможны две энергетически одинаковые вырожденные конформации кресла. При переходе их друг в друга аксиальные превращаются в экваториальные и наоборот. Такой процесс называют инверсией цикла.
Если имеется монозамещенное производное циклогексана, то возможны две конформации с экваториальным и аксиальным расположением заместителя. Энергетически наиболее выгодна конформация с экваториальным расположением заместителя.
Аксиальное положение (а) Экваториальное положение (е)
R– группы R- группы
Конформации гетероциклов
Широкое распространение имеет насыщенный шестичленный гетероцикл с атомом кислорода – тетрагидропиран.( входит в состав углеводов). Этот цикл называют пиранозным.Он существует в наименее напряженной конформации кресло. Для пиранозного цикла возможны две конформации кресла, которые энергетически неравноценны (не вырождены) по сравнению с циклогексаном. При взаимопревращении этих конформаций экваториальные связи становятся аксиальными и наоборот.

4. Делокализации электронов как один из важных факторов повышения устойчивости молекул и ионов. Сопряжение (π,π- и р,π- сопряжение). Энергия сопряжения (делокализация). Сопряженные системы с открытой цепью: 1,3-диены (бутадиен, изопрен, аллильный карбкатион), полиены (каротиноиды, витамин А).



Сопряженная система представляет собой систему, в которой имеет место чередование простых и кратных связей или по другому – система, в которой кратные связи находятся друг от друга на расстоянии одной одинарной связи. Такая цепь сопряженных связей называется цепью конъюгации (от латинского conjugati – наложение, перекрывание) В сопряженных системах имеет место дополнительное перекрывание π-электронных облаков кратной связи. Двойная связь представляет собой сочетание σ-связи и π-связи. В алкенах электронная плотность π-связи охватывает только 2 атома и ее называют локализованной. Локализованные двойные связи часто встречаются в природных соединениях, например в ненасыщенных карбоновых кислотах.
В сопряженных системах происходит такое электронное взаимодействие, при котором электронная плотность в молекуле распределяется равномерно, т.е. образуется общая электронная плотность.

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
Читайте также:
