Для профилактики воздушной эмболии при катетеризации подключичной вены обязательно положение кровати
Обновлено: 18.05.2024
Успех пункции и катетеризации подключичной вены во многом обусловлен соблюдением всех требований к проведению этой манипуляции. Особое значение имеет правильная укладка пациента.
Положение больного горизонтальное с подложенным под плечевым поясом («под лопатками») валиком, высотой 10-15 см. Головной конец стола опущен на 25-30 градусов (положение Тренделенбурга). Верхняя конечность на стороне пункции приведена к туловищу, надплечье опущено (с оттягиванием помощником верхней конечности вниз), голова повернута в противоположную сторону на 90 градусов. В случае тяжелого состояния больного можно производить пункцию в полусидячем положении и без подкладывания валика.
Положение врача – стоя со стороны пункции.
Предпочтительная сторона: правая, так как в конечный отдел левой подключичной вены могут впадать грудной или яремный лимфатические протоки. Кроме того, при осуществлении электрокардиостимуляции, зондирования и контрастирования полостей сердца, когда возникает необходимость продвижения катетера в верхнюю полую вену, это осуществить легче справа, так как правая плечеголовная вена короче левой и направление ее приближается к вертикальному, тогда как направление левой плечеголовной вены ближе к горизонтальному.
После обработки рук и соответствующей половины передней области шеи и подключичной области антисептиком и ограничения операционного поля пеленкой-разрезкой или салфетками (см. раздел «Основные средства и организация проведения пункционной катетеризации центральных вен») проводится обезболивание (см. раздел «Обезболивание»).
Принцип проведения катетеризации центральных вен заложен Сельдингером (1953). Пункция осуществляется специальной иглой из набора для катетеризации центральных вен, насаженной на шприц с 0,25% раствором новокаина. Пациентам, находящимся в сознании, иглу для пункции подключичной вены показывать крайне нежелательно, так как это является мощным стрессовым фактором (игла длиной 15 см и более с достаточной толщиной). При проколе иглой кожи отмечается значительное сопротивление. Этот момент и является наиболее болезненным. Поэтому его необходимо проводить максимально быстро. Это достигается приемом ограничения глубины введения иглы. Врач, выполняющий манипуляцию ограничивает пальцем иглу на расстоянии 0,5-1 см от ее острия. Это предотвращает глубокое неконтролируемое введение иглы в ткани при приложении значительного усилия во время прокола кожи. Просвет пункционной иглы часто забивается тканями при проколе кожи. Поэтому сразу же после прохождения иглой кожного покрова необходимо восстановить ее проходимость, выпуская небольшое количества раствора новокаина. Вкол иглы производится на 1 см ниже ключицы на границе медиальной и средней ее трети (точка Обаньяка). Игле следует придавать направление на задне-верхний край грудино-ключичного сочленения или, согласно данным В.Н. Родионова (1996), на середину ширины ключичной ножки грудино-ключично-сосцевидной мышцы, то есть несколько латеральнее. Это направление остается выгодным и при различном положении ключицы. В результате сосуд пунктируется в области венозного угла Пирогова. Продвижению иглы следует предпосылать струю новокаина. После прокола иглой подключичной мышцы (ощущение провала) поршень следует потягивать на себя, продвигая иглу в заданном направлении (создавать разряжение в шприце можно только после выпускания небольшого количества раствора новокаина для профилактики забивания просвета иглы тканями). После попадания в вену в шприце появляется струйка темной крови и далее иглу продвигать в сосуд не следует из-за возможности повреждения противоположной стенки сосуда с последующим выходом туда проводника. Если больной в сознании, его надо попросить задержать дыхание на вдохе (профилактика воздушной эмболии) и через просвет иглы, снятой со шприца, ввести лесочный проводник на глубину 10-12 см, после чего игла извлекается, а проводник при этом придерживается и остается в вене. Затем по проводнику вращательными движениями по часовой стрелке продвигается катетер на указанную ранее глубину. В каждом конкретном случае должен соблюдаться принцип выбора катетера максимально возможного диаметра (для взрослых внутренний диаметр – 1,4 мм). После этого проводник удаляется, а в катетер вводится раствор гепарина (см. раздел «уход за катетером») и вставляется канюля-заглушка. Во избежание воздушной эмболии, просвет катетера во время всех манипуляций следует прикрывать пальцем. Если пункция не удалась, необходимо иглу вывести в подкожную клетчатку и продвинуть вперед в другом направлении (изменения направления хода иглы в процессе пункции приводят к дополнительному повреждению тканей). Катетер фиксируется к коже одним из ниже перечисленных способов:
вокруг катетера на кожу наклеивается полоска бактерицидного пластыря с двумя продольными прорезями, после чего осуществляется тщательная фиксация катетера средней полоской лейкопластыря;
чтобы обеспечить надежную фиксацию катетера некоторые авторы рекомендуют подшивать его к коже. Для этого в непосредственной близости от места выхода катетера кожа прошивается лигатурой. Первый двойной узел лигатуры завязывается на коже, вторым катетер фиксируется к кожному шву, третий узел завязывается на протяжении лигатуры на уровне канюли и четвертый – вокруг канюли, что препятствует смещению катетера по оси.
Катетер-ассоциированные инфекции кровотока ( Ангиогенные инфекции , Катетерные инфекции )
Катетер-ассоциированные инфекции кровотока (КАИК) – это нозокомиальные инфекционные осложнения, связанные с использованием внутрисосудистых катетеров. Клинически проявляются местными воспалительными изменениями (отек, болезненность, гиперемия в области катетера) или генерализованной инфекцией (фебрильная лихорадка, озноб, бактериемия). Для лабораторного подтверждения КАИК осуществляется посев крови на гемокультуру и микробиологическое исследование сосудистого катетера. При первых признаках КАИК производится удаление катетера, назначается антибактериальная, инфузионная терапия.
МКБ-10
Общие сведения
Катетер-обусловленные инфекции кровотока (ангиогенные, «катетерные» инфекции) – группа внутрибольничных инфекций, развивающихся вследствие катетеризации сосудов. Частота возникновения ангиогенных инфекций в отделениях ОРИТ составляет от 3 до 7 случаев на 1000 катетеро-дней. В Европе и США ежегодно регистрируется более 500 тыс. подобных осложнений. Потребность в центральном сосудистом доступе высока в отделениях реанимации, гемодиализа, онкологии, гематологии и др., что делает катетер-ассоциированные инфекции мультидисциплинарной проблемой, актуальной для различных медицинских сфер.
Причины
Установка внутрисосудистого устройства (ВСУ) – инвазивная манипуляция, сопряженная с нарушением целостности кожных покровов и сосудистой стенки, внедрением и оставлением в просвете сосуда инородного предмета. Катетерные инфекции кровотока в большинстве случаев ассоциированы с установкой центрального венозного катетера (ЦВК), инфузионной порт-системы, периферической венозной канюли. Чаще КАИК развиваются при катетеризации бедренной вены, реже – подключичной и внутренней яремной.
Развитию ангиогенных инфекций предшествует контаминация сосудистого устройства патогенными или условно-патогенными микроорганизмами. Источниками и причинами обсеменения могут стать:
- инфекции кожи в области сосудистого протеза (пиодермии);
- несоблюдение требований асептики при манипуляциях с ЦВК (ненадлежащая обработка операционного поля, рук врача);
- неадекватный выбор доступа, размера, типа и материала катетера;
- частые пункции сосудистого русла;
- плохой уход за сосудистым протезом.
Среди этиологических агентов, вызывающих КАИК, преобладают возбудители, которые являются самой частой причиной ВБИ: стафилококки (47%, из них золотистый стафилококк ‒ 25%), энтеробактерии (27%), ацинетобактеры (13%), синегнойная палочка (9%), кандиды (5%), энтерококки (3%) и др. Большую роль в возникновении внутрисосудистых инфекций, играет срок катетеризации: по опубликованным данным, через 7 дней нахождения катетера в вене КАИК развивается у 5%пациентов, через 1 месяц и более – у 36%.
Факторы риска
Инфицированию внутривенных катетеров способствуют сопутствующие состояния: сахарный диабет, иммунодефициты и иммуносупрессия, гипоальбуминемия. В группу повышенного риска по развитию катетер-ассоциированных инфекций кровотока входят пациенты, имеющие значительную катетеризационную нагрузку (длительную и неоднократную пункцию центральных вен):
- находящиеся на гемодиализе;
- получающие массивную инфузионно-трансфузионную терапию;
- проходящие химиотерапию;
- требующие проведения эфферентных методов детоксикации;
- нуждающиеся в парентеральном питании.
Патогенез
Механизм развития КАИК реализуется тремя основными путями. Чаще всего инфекция проникает в кровоток с обсемененных кожных покровов по наружной поверхности катетера (экстралюминально). Такой путь наиболее актуален в ранние сроки после постановки катетера (первые 10-15 суток). В последующем увеличивается доля интралюминального инфицирования, когда инфекция распространяется по внутренней стороне протеза через контаминированные инфузионные среды, канюли шприцев и систем для переливания. Также возможно гематогенное инфицирование, при котором возбудители оседают на катетере, разносясь с током крови из других источников (при пневмонии, панкреатите и пр.).
Внутрисосудистое устройство является инородным телом, поэтому в ответ на его введение организм вырабатывает различные белковые вещества, отграничивающие его от собственных тканей. В их числе ‒ фибрин и фибронектин, к которым легко прикрепляется коагулаза – фермент, продуцируемый многими патогенами, в частности, золотистым стафилококком и кандидой.
В результате такой адгезии внутри сосудистого протеза образуется биопленка, защищающая микробные колонии от воздействия антибиотиков и клеток иммунной системы. Это способствует переходу инфекции в персистирующую хроническую форму. Микробные биопленки образуются на внутренней поверхности имплантируемых устройств в 40% случаев.
Наличие биопленки снижает чувствительность патогенов к антибиотикам в сотни раз, способствует увеличению в структуре ВБИ доли антибиотикорезистентных штаммов, устойчивых практически ко всем известным противомикробным препаратам. Рост колоний микроорганизмов сопровождается фрагментацией биопленки и попаданием патогенов в кровоток, что приводит развитию бактериемии и сепсиса.
Классификация
В настоящее время в медицинских кругах используется классификация катетер-ассоциированных инфекций кровотока, рекомендованная Комитетом по контролю за госпитальными инфекциями (США). Согласно ей, различают следующие формы КАИК:
- Колонизация катетера, подтвержденная микробиологическим исследованием, при отсутствии любых клинических проявлений.
- Флебит: эритема, уплотнение, болезненность катетеризированной вены при пальпации.
- Ограниченная инфекция в месте установки катетера: инфильтрат, болезненность тканей, гиперемия, наличие гнойного отделяемого, очаг не более 2 см.
- Инфекция подкожного кармана, содержащего установленную порт-систему: гиперемия и некроз кожи над имплантируемым устройством, гнойное отделяемое в подкожном кармане.
- Туннельная инфекция: признаки воспаления, распространяющегося по ходу катетера более 2-х см от места его установки.
- Инфекции кровотока: бактериемия, фунгемия, сепсис, при которых один и тот же возбудитель высевается из кровотока и из удаленного ВСУ.
- КАИК, ассоциированные с инфузионной средой: контаминированными растворами, гемокомпонентами.
Симптомы КАИК
Катетер-асоциированные инфекции кровотока могут быть локальными (37%) и генерализованными (63%). Первые из них ограничены местом установки сосудистого протеза, вторые характеризуются бактериемией и системным поражением. Местные инфекции представлены инфильтратами, абсцессами, флебитами, непосредственно связанными с установленным внутрисосудистым устройством. Генерализованные КАИК проявляются сепсисом.
На высокую вероятность КАИК указывает появление признаков воспаления вокруг сосудистого катетера: уплотнение и покраснение кожи, боли, отделение гнойного экссудата, нарушение проходимости протеза. Общие симптомы инфекционного процесса ‒ лихорадка с ознобом ‒ обычно возникают через 20 минут–1,5 часа после использования катера (забора крови, вливания растворов). В тяжелых случаях лихорадка становится фебрильной и практически постоянной, снижается АД, нарастают признаки интоксикации. Развивается катетер-ассоциированный ангиогенный сепсис.
Осложнения
Длительное нахождение катетера в сосудистом просвете повышает риск развития тромбофлебита, тромбоза глубоких вен. КАИК могут осложниться септикопиемией ‒ формированием метастатических гнойных отсевов различной локализации. Среди них – бактериальный эндокардит, абсцедирующая пневмония, септический артрит, гематогенный остеомиелит и др. Причиной гибели пациентов становится септический шок, полиорганные нарушения, фатальные тромбоэмболии.
Диагностика
Клиническим критерием КАИК считается появление у пациента симптомов инфекции кровотока спустя 48 часов и более после установки ЦВК при отсутствии других источников инфекции. Однако из-за низкой специфичности клинических данных диагноз катетер-ассоциированной инфекции требует обязательного лабораторного подтверждения. Для этого производится парный посев:
- крови из периферической вены и дистального конца внутрисосудистого катетера (либо смыва из него). КАИК считается достоверной при одновременном выделении одной и той же гемокультуры из периферической крови и сосудистого зонда (>15 КОЕ полуколичественно и >102 КОЕ количественно);
- крови из сосудистого протеза и вены. На КАИК указывает более чем 3-кратное превышение количества колоний в образце крови из катетера по сравнению с венозным образцом.
Забор крови необходимо производить двукратно, до начала антибиотикотерапии, на высоте лихорадки. Для уточнения осложнений осуществляются инструментальные исследования. При подозрении на гнойный тромбофлебит выполняется УЗДС сосудов, флебография. Исключить или подтвердить септический эндокардит помогает трансторакальная ЭхоКС. Методами диагностики гнойных процессов костно-суставной системы является рентген, УЗИ суставов.
Ангиогенные инфекции дифференцируют с бактериемией, ассоциированной с другими первичными источниками: пневмонией, гнойными ранами, интраабдоминальными абсцессами и др.
Лечение катетер-ассоциированных инфекций кровотока
В случае отсутствия локальной инфекции предпринимают попытку санации катетера методом «антибактериального замка» ‒ в просвет ЦВК вводят раствор антибиотика и оставляют на несколько часов. При наличии выраженных признаков местного воспаления необходимо незамедлительное удаление инфицированного внутрисосудистого устройства. При локальных формах КАИК может потребоваться наложение антисептических и мазевых повязок, вскрытие абсцессов и гнойных затеков с последующим ведением гнойной раны согласно принятому протоколу.
Системную антибиотикотерапию начинают, не дожидаясь результатов бакпосева, при необходимости в дальнейшем ее корректируют с учетом выделенной флоры и чувствительности. Обычно используются пенициллины, цефалоспорины, гликопептиды, аминогликозиды длительностью не менее 14 дней. Для терапии грибковой инфекции назначают амфотерицин В, флуконазол. При явлениях тромбофлебита показано введение антикоагулянтов, фибринолитиков. В отношении флегмон, гнойного артрита, остеомиелита, абсцессов различной локализации применяется соответствующая хирургическая тактика.
Прогноз
Катетер-ассоциированные инфекции кровотока являются серьезным вызовом современной медицине ввиду их распространенности и антибиотикорезистентности. Они удлиняют сроки госпитализации, утяжеляют исход основного заболевания, требуют значительных финансовых затрат для лечения. Неосложненные ангиогенные инфекции обычно разрешаются в течение нескольких суток. КАИК, осложненные местным нагноительным процессом или бактериемией, имеют серьезный прогноз и высокую летальность.
Профилактика
Современные протоколы четко регламентируют правила установки и ухода за ВСУ. Наибольшее внимание при этом уделяется соблюдению норм асептики и антисептики (дезинфекция операционного поля и рук персонала, хранение крышек катетеров в растворе хлоргексидина, обработка кожи и смена повязок вокруг ВСУ). Необходимо правильно осуществлять выбор внутрисосудистого устройства и места для катетеризации, максимально ограничивать срок эксплуатации внутривенных зондов, использовать гепариновые и антибактериальные замки.
1. Профилактика катетер-ассоциированных инфекций кровотока и уход за центральным венозным катетером (ЦВК). Клинические рекомендации. – 2017.
2. Комплексная клинико-этиологическая и эпидемиологическая характеристика катетер-ассоциированных инфекций кровотока/ Квашнина Д. В., Ковалишена О.В., Белянина Н.А.// Медицинский альманах. – 2017.
3. Распространенность и критерии диагностики катетер-ассоциированных инфекций кровотока/ Везирова З.Ш.// Вестник хирургии Казахстана. – 2014.
4. Инфекции, связанные с внутрисосудистыми устройствами: терминология, диагностика, профилактика и терапия/ Багирова Н.С.// Злокачественные опухоли. – 2014.
Воздушная эмболия
Воздушная эмболия – это закупорка кровеносного русла пузырьками воздуха, попавшими в кровоток из внешней среды. Клинические проявления зависят от типа и величины пораженного сосуда. Наиболее опасна обтурация коронарных и легочных артерий, системы кровоснабжения головного мозга. При поражении ЛА возникают признаки острой дыхательной и сердечной недостаточности. Церебральная форма болезни протекает с развитием симптоматики ишемического инсульта. Диагноз устанавливается на основании клинической картины, данных доплерографии, капнограммы, измерения ЦВД. Специфическое лечение – аспирация газа через катетер, восстановление целостности сосудистого русла.
Воздушная эмболия (ВЭ) – острое патологическое состояние, возникающее при попадании в кровеносный сосуд воздуха извне. Количество одномоментно введенного газа должно составлять не менее 10-20 мл, в противном случае он растворится в крови, не нанося вреда. Патология считается достаточно редкой, на ее долю приходится не более 2% от всех возможных видов сосудистой окклюзии. С одинаковой частотой определяется у мужчин и женщин, не имеет привязки к возрасту. Смертность при своевременной диагностике и оказании квалифицированной помощи колеблется от 10 до 40%. Отсутствие медицинского пособия при эмболизации легочных и церебральных сосудов приводит к гибели больного в 90% случаев.
Самопроизвольное попадание воздуха в кровеносную систему здорового человека практически исключено. Давление в большинстве сосудов избыточно по отношению к атмосфере, поэтому засасывания газов при повреждении сосудистой стенки не наблюдается. Исключение – внутренняя яремная вена, давление в которой при вдохе ниже атмосферного. Иначе выглядит ситуация с обезвоженными пациентами. За счет уменьшения ОЦК давление в центральных сосудах становится отрицательным, нарушение целостности стенки сосуда может привести к попаданию внутрь газов из окружающей среды. К распространенным причинам воздушной окклюзии относятся:
- Травматизация. Атмосферные газы проникают в кровь при баротравме легких (резкое всплытие с глубины, неправильно подобранный режим аппарата ИВЛ), повреждениях грудной клетки, сопровождающихся разрывом кровеносных сосудов. ВЭ также выявляется на фоне травм других анатомических зон при отсутствии своевременной остановки профузного кровотечения.
- Роды. Проникновение газов становится возможным при разрыве плацентарных венозных синусов. Воздух в поврежденные сосуды нагнетается под давлением во время маточных сокращений. Заболевание развивается независимо от величины центрального венозного давления. Симптоматика может возникать не только непосредственно в родах, но и спустя 1-2 суток.
- Медицинские процедуры. К манипуляциям с высоким риском формирования ВЭ относят операции на сосудах, органах грудной клетки, головном мозге, если в ходе вмешательства производится вскрытие венозного синуса. Кроме того, воздух систему кровоснабжения может попадать при неплотном соединении инфузионной системы с центральным венозным катетером или в процессе инфузионной терапии. Подобное происходит при отрицательном ЦВД.
Крупные пузыри воздуха в кровеносном русле могут приводить к окклюзии любых сосудов. Чаще всего блокируются легочные вены, сосуды сердца, артериальные стволы, питающие мозг. При поражении легочной артерии отмечается региональная внутрисосудистая гипертензия, перегрузка ПЖ и острая правожелудочковая недостаточность. Далее в процесс вовлекается левый желудочек, снижается сердечный выброс, нарушается периферическое кровообращение, развивается шок. Воздушная эмболия ЛА сопровождается возникновением бронхоспазма, вентиляционно-перфузионного дисбаланса, инфаркта легкого и дыхательной недостаточности.
При нарушении кровотока в мозговых сосудах формирование патологии происходит по типу ишемического инсульта. На определенном участке мозга нарушается кровоснабжение, нейроткань испытывает кислородное голодание и отмирает. Образуется участок некроза, происходят множественные мелкие кровоизлияния в мозговую ткань. Дальнейшее течение болезни зависит от локализации пораженного участка. Могут обнаруживаться парезы, параличи, нарушение когнитивных функций, сбои в деятельности внутренних органов.
Существует несколько критериев систематизации ВЭ. Воздушная эмболия классифицируется по характеру течения (молниеносная, острая и подострая), пути проникновения воздуха в кровоток (ятрогенная, травматическая), направлению движения эмбола (ортоградная, ретроградная, парадоксальная). В клинической практике используют разделение форм болезни по виду пораженного сосуда, включающее следующие варианты патологии:
- Артериальная. Наблюдается закупорка крупных артериальных стволов (коронарных, легочных, церебральных). Встречается в 30-35% случаев, развивается молниеносно, протекает тяжело, с выраженной клинической симптоматикой. Пациент погибает в течение нескольких часов, иногда – минут. Для формирования АВЭ необходимо более 40-50 см 3 газа, одномоментно попавшего в кровоток.
- Венозная. Обнаруживается в 65-70% случаев. Приводит к нарушению венозного оттока. Симптоматика прогрессирует сравнительно медленно, жизнеугрожающие состояния выявляются редко. Склонна к подострому течению. При закупорке мелких вен и венул может протекать бессимптомно, кровоток при этом обеспечивается за счет системы коллатералей. Исключение – воздушная окклюзия легочных вен, по которым насыщенная кислородом кровь поступает от легких к сердцу.
Симптомы воздушной эмболии
Клиническая картина различается в зависимости от вида и размера пораженного сосуда. При нарушении оттока крови по крупным периферическим венам возникают типичные признаки тромбоза. Пораженный участок отекает, увеличивается в размерах. При сдавливании определяется сильная болезненность. Кожа в зоне патологии цианотична, имеет место локальная гипертермия. Системной реакцией является умеренная тахикардия, вызванная депонированием определенного объема жидкости и уменьшением ОЦК.
Воздушная эмболия мелких ветвей легочной артерии вызывает кашель, кровохарканье, эпизоды синкопэ, одышку более 20 вдохов, тахикардию в пределах 100-120 ударов в минуту. Нарушения гемодинамики отсутствуют. При закупорке крупных стволов развивается картина острого легочного сердца. У больного выявляется резкая гипотония, набухание шейных вен, увеличение размеров печени, рост ЦВД, психомоторное возбуждение, усиление сердечного толчка. Кожа бледная, холодная, покрыта липким потом.
Поражение коронарных артерий приводит к возникновению острого инфаркта миокарда. Отмечаются типичные боли за грудиной сжимающего характера. Применение нитратов не дает ожидаемого эффекта. АД снижается вплоть до шоковых цифр. Возможен отек легких сердечного происхождения. Типичная картина ОИМ наблюдается не всегда. В 40% случаев болезнь протекает в атипичном варианте, проявляется болями в животе, горле, левой руке и т. д.
Эмболизация структур кровоснабжения мозга становится причиной инсульта. В тканях мозга образуется очаг некроза, от локализации которого зависит клиническая симптоматика. К наиболее распространенным признакам ишемического инсульта относят парезы и параличи, локальное снижение мышечного тонуса, парестезии, расстройства речи, нечеткость зрения, головокружение, головную боль, нарушения устойчивости, дроп-атаки, ослабление кожной чувствительности.
При эмболизации периферических артерий образуются трофические язвы, возникают зоны некроза. Нарушение венозного оттока в конечностях приводит к отекам. Изменения со стороны системы кровоснабжения внутренних органов становятся причиной ослабления или полного прекращения их деятельности. Может развиваться острая почечная или печеночная недостаточность, парез кишечника, недостаточность функции сердца и легких. Поражение церебральных кровеносных структур провоцирует необратимые нарушения в работе организма. Наблюдаются параличи, нарушения в психоэмоциональной сфере, изменения в работе внутренних органов, иннервируемых поврежденным участком мозга.
Диагностику ВЭ осуществляет анестезиолог-реаниматолог в тандеме с непосредственным лечащим врачом пациента. Данные клинического обследования в сочетании с информацией, полученной при использовании аппаратных диагностических методик, обычно не оставляют сомнений в диагнозе. Сложности возникают при определении вида эмболии. Следует дифференцировать окклюзию сосудов, вызванную воздухом, пузырьками газа, образующимися эндогенно при резком изменении давления окружающей среды (кессонная болезнь, газовая эмболия), тромбом, опухолью, инородным телом, конгломератом бактериальных клеток. К числу диагностических мероприятий относятся:
- Физикальные. Проводятся в отделении реанимации или по месту нахождения пациента. В ходе осмотра выявляют косвенные признаки тромбоза и ставят предварительный диагноз. Нужно учитывать, что болезнь далеко не всегда протекает с полным набором симптомов, частота встречаемости некоторых из них не превышает 50-60%.
- Лабораторные. На начальных этапах развития ВЭ лабораторное обследование не слишком информативно. Отмечаются изменения состава газов крови, кислотно-щелочного равновесия, баланса электролитов. При поражении внутренних органов и развитии полиорганной недостаточности происходит увеличение активности печеночных ферментов, рост концентрации креатинина и мочевины в крови. Деструктивные процессы в мышечной ткани становятся причиной повышения уровня миоглобина.
- Инструментальные. При проведении прекардиальной, трансэзофагальной или транскраниальной допплерографии удается установить факт наличия воздуха в сосудах. Исследование является качественным, определить объем газа с его помощью невозможно. Капнограмма свидетельствует об увеличении концентрации углекислого газа в конце выдоха, при измерении ЦВД выявляется неадекватный рост показателей. На ЭКГ обнаруживаются желудочковые экстрасистолы, изменения зубца P, депрессия сегмента ST.
Лечение воздушной эмболии
Устранение последствий попадания воздуха в сосуды производят с использованием медикаментозных и аппаратных способов лечения. Объем необходимой помощи зависит от состояния пациента, выраженности нарушения жизненно важных функций, наличия в клинике необходимого оборудования. Обычно схема восстановительных мероприятий включает в себя следующие методы воздействия:
- Неспецифические медикаментозные. Лечение направлено на минимизацию клинических признаков болезни и предотвращение осложнений. Пациенту назначают стероидные гормоны, кардиотоники, петлевые диуретики, сосудорасширяющие средства, антиоксиданты. На этапе восстановления используют поливитаминные комплексы, ноотропные препараты. При выраженной дыхательной недостаточности больного переводят на ИВЛ в режиме принудительной вентиляции.
- Аппаратные. Воздушная эмболия лечится с помощью гипербарической оксигенации и управляемой гипотермии. ГБО осуществляется под давлением 2-3 атмосферы, количество сеансов варьируется от 5 до 12. Продолжительность каждого из них – 45 минут. При использовании гипотермии тело больного охлаждают до 34°C. Как баролечение, так и холод способствуют увеличению растворимости газов в крови, что позволяет уничтожить тромб, недоступный для удаления оперативным путем.
- Оперативные. Оптимальным методом извлечения эмбола при внутрисердечной ВЭ является его аспирация через подключичный катетер. При этом происходит удаление нескольких сотен миллилитров крови, что может потребовать проведения массивной инфузионной терапии или гемотрансфузии. При точном определении локализации эмбола возможно вскрытие сосуда или венозного синуса.
Прогноз и профилактика
Исход благоприятный в тех случаях, когда воздух удается удалить с помощью малотравматичного подключичного доступа. При внутричерепной или легочной локализации эмбола прогноз ухудшается, поскольку извлечь его хирургическими методами практически невозможно. Применение ГБО и гипотермии не позволяет быстро нормализовать кровоток, следовательно, повышается вероятность необратимых последствий. При поражении периферических вен и артерий угроза для жизни обычно отсутствует, но восстановление пораженных тканей протекает длительно, полной регенерации удается добиться не всегда.
Воздушная эмболизация наиболее часто возникает в ходе медицинских манипуляций, поэтому мероприятия по ее профилактике полностью ложатся на сотрудников лечебного учреждения. При вмешательствах на верхней полой вене больной должен находиться в положении Транделенбурга, катетеризация подключичной вены в момент, когда игла остается с открытым торцом (отсоединение шприца, извлечение проводника), проводится на глубоком выдохе больного. При низком ЦВД следует своевременно перекрывать окончившиеся инфузионные системы.
1. Роль артериальной воздушной эмболии в патогенезе минно-взрывной травмы: Автореферат диссертации/ Найденов А.А. – 1997.
2. Парадоксальная воздушная эмболия, приведшая к развитию острого инфаркта миокарда и массивному ишемическому поражению головного мозга у пациента, оперированного в положении сидя/ Ананьев Е.П., Полупан А.А. и соавт.// Вопросы нейрохирургии. – 2016 - №2.
3. Интраоперационная ультразвуковая диагностика в профилактике воздушной эмболии при операциях на открытом сердце: Автореферат диссертации/ Родионова Л.В. – 2007.
4. Воздушная эмболия в судебно-медицинской и прозекторской практике/ Монастырская Б.И., Бляхман С.Д. – 1963.
3. Пункция и катетеризация подключичной вены
Пункцию и катетеризацию подключичной вены обычно производит хирург или анестезиолог, иногда — специально обученный терапевт. Многие больные из отделений интенсивной терапии, хирургических стационаров переводятся для дальнейшего лечения в терапевтические отделения, где продолжается их интенсивное лечение, в том числе и через катетер в подключичной вене. В любом случае врачу-терапевту необходимо владеть навыками ухода за таким катетером.
Показания к катетеризации подключичной вены:
1) недоступность периферических вен;
2) длительные операции с большой кровопотерей;
3) необходимость в многосуточной и интенсивной инфузионной терапии;
4) необходимость парентерального питания;
5) потребность в диагностических и контрольных исследованиях (измерение центрального венозного давления, давления в полостях сердца, рентгеноконтрастные исследования, многократные взятия проб крови);
6) проведение сеансов плазмафереза или гемосорбции.
Противопоказания к катетеризации: 1) синдром верхней полой вены; 2) резкие нарушения свертывающей системы крови; 3) локальные воспалительные процессы в местах катетеризации вены; 4) выраженная дыхательная недостаточность с эмфиземой; 5) двусторонний пневмоторакс; 6) травма области ключиц.
Техника проведения манипуляции довольно проста. Подключичная вена проходит под передне-верхней поверхностью 1 ребра и задней поверхностью ключицы. Ее протяженность 2-3 см, диаметр — до 2 см и более. Стенки подключичной вены в промежутке между 1 ребром и ключицей фиксируются к этим костным образованиям отрогами шейных фасций и фасций, покрывающих подключичную вену. В связи с этим стенки вены не спадаются. Это и обеспечивает относительную легкость катетеризации, а высокая объемная скорость кровотока в подключичной вене препятствует образованию тромбов и выпадению на катетере фибрина.
При пункции подключичной вены больной должен лежать на спине. Под лопатки ему подкладывают валик высотой до 10 см. Голова должна быть повернута в сторону, противоположную пункции. Для профилактики воздушной эмболии головной конец кровати опускают или ногам придается возвышенное положение. Руки больной располагает вдоль туловища.
Кожу в месте пункции обрабатывают так же, как при любой хирургической операции. Проводят местную анестезию раствором новокаина (допустим и внутривенный наркоз).
Наиболее удобной для пункции считается точка Обаньяка, располагающаяся под ключицей (на 1 см ниже ее), на границе ее внутренней и средней третей. Указательным пальцем левой руки нащупывают под ключицей 1 ребро, выступающее в этом месте из-под ключицы. Точка прокола находится между пальпирующим пальцем и ключицей (Рис. 1).
Специальную иглу продвигают по направлению вверх и внутрь на заднюю и верхнюю части грудино-ключичного сочленения. Ее конец должен скользить по задней поверхности ключицы.
Рис. 1. Точка Обаньяка для пункции подключичной вены
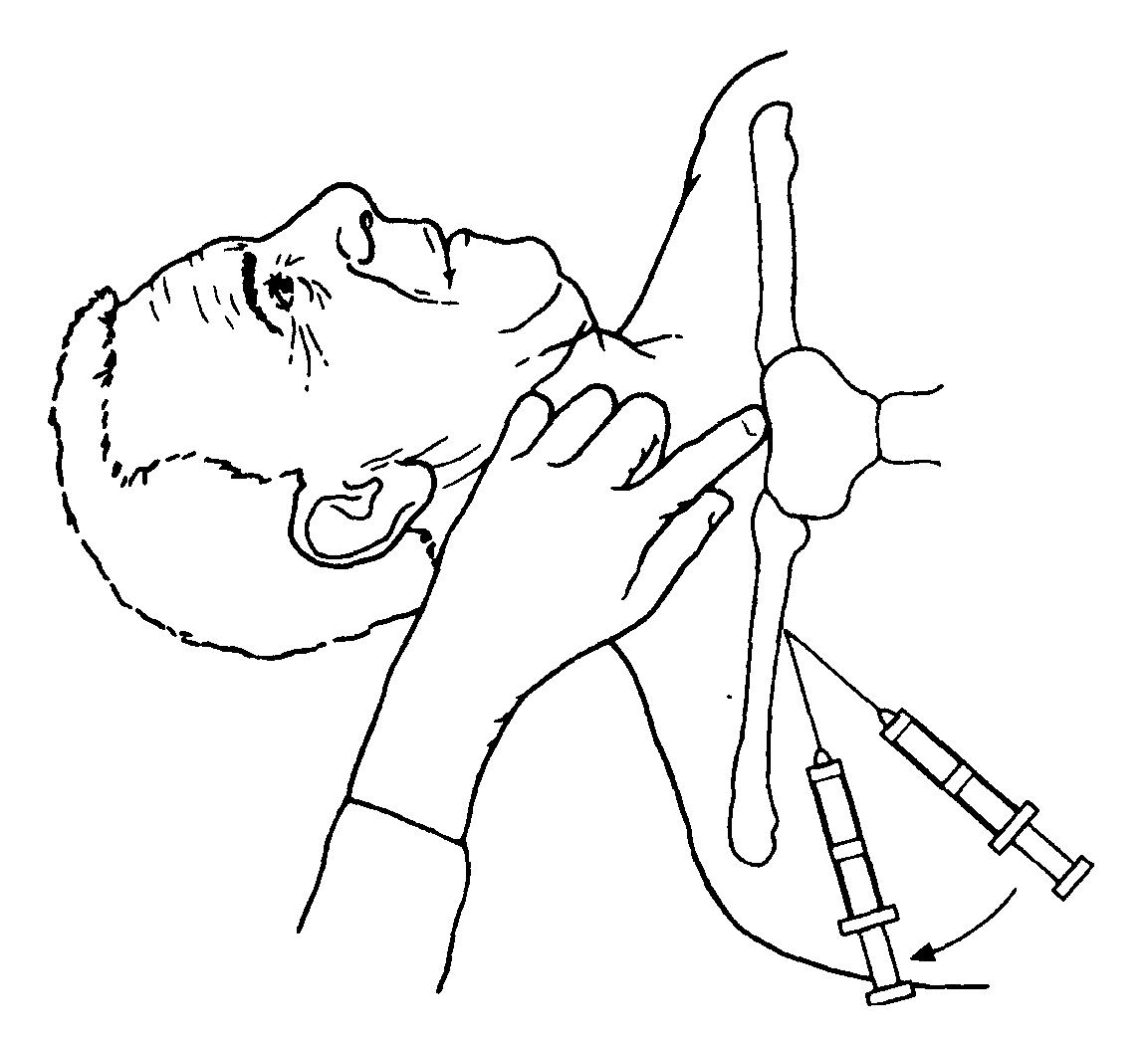
Медленно продвигая иглу вглубь по избран-ному направлению, стараются оттягивать пор-шень шприца на себя. Появление в шприце струи крови свидетельствует о том, что игла попала в подключичную вену. После попадания в вену иглу продвигают вперед еще на 2-3 см под контролем поступления крови в шприц. Затем шприц снимают. Канюлю иглы немедленно перекрывают пальцем для профи-лактики воздушной эмболии. Через просвет иглы в момент выдоха больного или на задержке дыхания в вену вводят проводник (рыболовная леска) на глубину примерно 15 см. После этого иглу извлекают, а проводник оставляют в подключичной вене. По нему вращательно-поступательными движениями проводят полиэтиленовый катетер на глубину 5-10 см до верхней полой вены. После этого проводник удаляют и шприцем контролируют нахождение катетера в вене. Его надежно фиксируют лейкопластырем или шелковым швом к коже. Измеряют длину свободной части катетера (в последующем ее периодически перепроверяют для контроля в связи с возможной его дислокацией).
По окончании каждой трансфузии в катетер вводят иглой до 0,5 мл гепарина. В перерывах между вливаниями катетер закрывают пробкой. Ежедневно перед началом трансфузий в шприц из катетера берут кровь. Если кровь поступает в шприц легко и обильно, значит, катетер находится в вене.
Обычно длительность пребывания катетера в подключичной вене не должна превышать 5—10 дней. При длительном пребывании катетера в вене возникает опасность развития инфекционных осложнений, клинически протекающих в виде местного воспаления кожи и подкожной клетчатки, сепсиса, лихорадки. Для предупреждения этих осложнений рекомендуется строго соблюдать правила асептики, постоянно контролировать место укола иглы, ежедневно менять асептические повязки.
Если известно, что катетеризация подключичной вены будет проводиться длительно, катетер рекомендуется фиксировать не лейкопластырем, а шелковыми швами. Лейкопластырь вызывает мацерацию кожи, что может провоцировать инфекционные осложнения. В случае фиксации катетера лейкопластырем, который следует ежедневно менять. К зоне вхождения катетера в кожу ежедневно прикладывают марлевый шарик, смоченный антисептическим раствором. Катетер немедленно удаляют при подозрении на его бактериальное инфицирование. У возбужденных, психически неадекватных больных конец катетера тщательно фиксируют лейкопластырем к коже, чтобы исключить возможность его выдергивания.
Осложнения: флебит и тромбофлебит. Их первыми симптомами могут быть чувство неловкости, тяжести или боли в надключичной области и плече, отечность тканей в области ключицы, отек соответствующей руки, лихорадка. Появление подобных симптомов служит абсолютным показанием к удалению катетера из вены. Катетер удаляют также при подозрении на наличие тромба. При этом больному назначают антикоагулянты, проводят противовоспалительную терапию.
7. Техника выполнения наиболее распространенных лечебно-диагностических манипуляций пункция и катетеризация подключичной вены
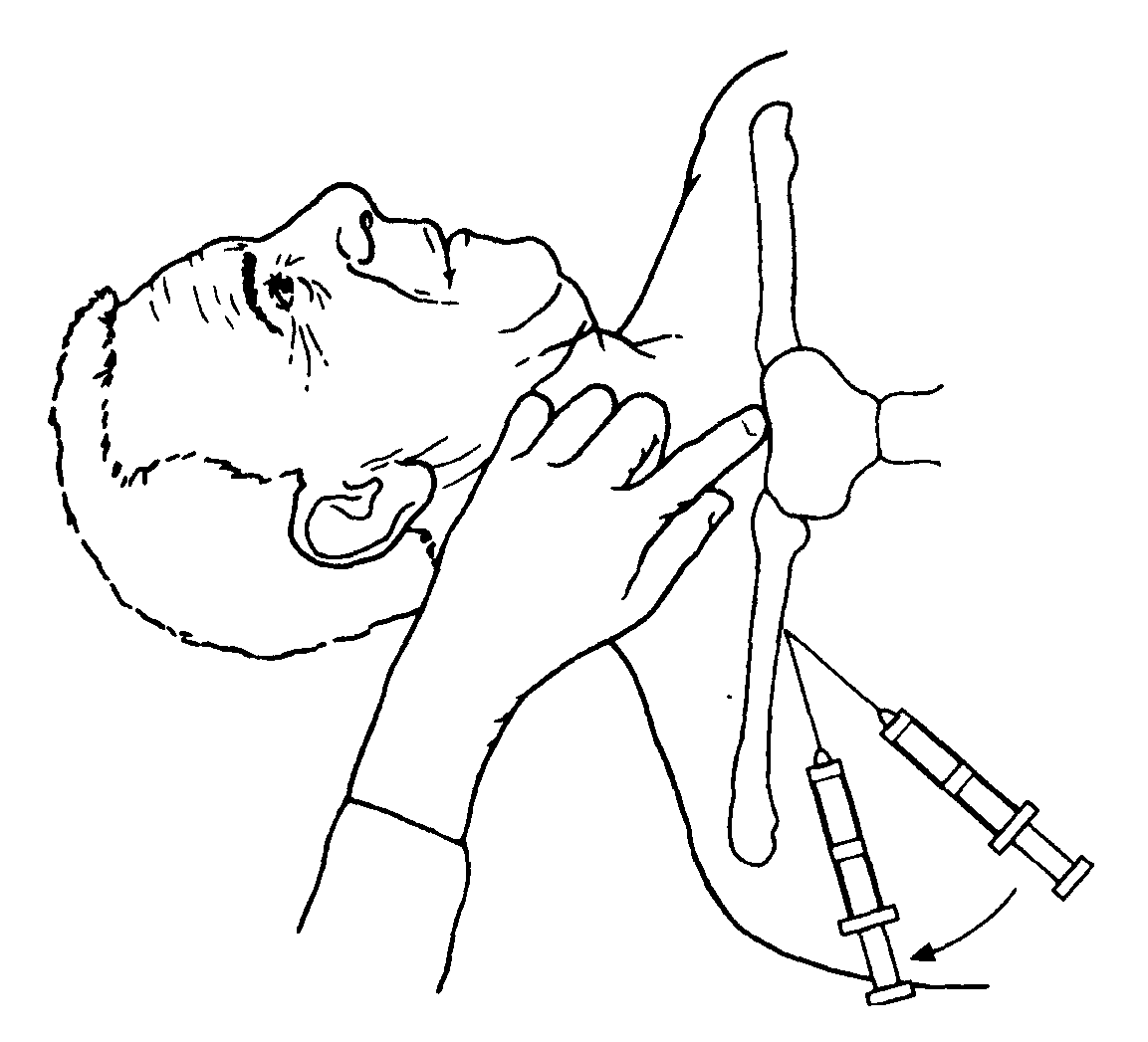
Медленно продвигая иглу вглубь по избран-ному направлению, стараются оттягивать пор-шень шприца на себя. Появление в шприце струи крови свидетельствует о том, что игла попала в подключичную вену. После попадания в вену иглу продвигают вперед еще на 2-3 см под контролем поступления крови в шприц. Затем шприц снимают. Канюлю иглы немедленно перекрывают пальцем для профи-лактики воздушной эмболии. Через просвет иглы в момент выдоха больного или на задержке дыхания в вену вводят проводник (рыболовная леска) на глубину примерно 15 см. После этого иглу извлекают, а проводник оставляют в подключичной вене. По нему вращательно-поступательными движениями проводят полиэтиленовый катетер на глубину 5-10 см до верхней полой вены. После этого проводник удаляют и шприцем контролируют нахождение катетера в вене. Его надежно фиксируют лейкопластырем или шелковым швом к коже. Измеряют длину свободной части катетера (в последующем ее периодически перепроверяют для контроля в связи с возможной его дислокацией).
Читайте также:
